
����Ŀ����A��B��C��D��E��F����ǰ�����ڵ�Ԫ�أ�ԭ��������������A��B��C��D��E��Ϊ������Ԫ�أ�D��FԪ�ض�Ӧ�ĵ���Ϊ�ճ������г���������Aԭ�Ӻ���ֻ��һ�����ӣ�Ԫ��A��B�γɵ���̬���������10e�����ռ乹��Ϊ�����Σ�CԪ��ԭ�ӵ�����������������Ӳ�����3����C��Eͬ���壮ͼ�о���D��FԪ�ص����ʾ�����ͼʾת����ϵ�� 
�پ���DԪ�ص��ҡ������������ת��ȫΪ��������ԭ��Ӧ��
�ھ���FԪ�ص��ң����ʣ��������������ת��ȫΪ������ԭ��Ӧ����ش��������⣺
��1��������ĵ���ʽΪ ��
��2��FԪ�������ڱ��е�λ���ȶ��ԣ�A2CA2E������ڡ���С�ڡ������ڡ�����
��3��������DԪ�ص����붡����Һ�з�����Ӧ�����ӷ���ʽ
��4���������ֱ��Ǻ�FԪ�صļ������ӣ����麬�������������ӵĻ����Һ�еĵͼ����ӣ�����������KMnO4��Һ�����Ӧ�����ӷ���ʽΪ��
��5����֪�����»�����FE��Ksp=6��10��18 mol2L��2 �� �����½�1.0��10��5molL��1��Na2E��Һ�뺬FSO4��Һ�������3��2��ϣ����г���F E���ɣ��������FSO4��Ũ��Ҫ�� �� �����Ի�Ϻ���Һ������仯����
���𰸡�
��1��![]()
��2���������ڵڢ��壻����
��3��Al3++3AlO2��+6H2O=4Al��OH��3��
��4��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O
��5�����ڻ����2.5��10��12mol/L
���������⣺A��B��C��D��E��F����ǰ�����ڵ�Ԫ�أ�ԭ��������������A��B��C��D��E��Ϊ������Ԫ�أ�D��FԪ�ض�Ӧ�ĵ���Ϊ�ճ������г���������AԪ��ԭ�Ӻ���ֻ��һ�����ӣ���AΪHԪ�أ�CԪ��ԭ�ӵ�����������������Ӳ�����3������Cԭ�Ӻ�����2�����Ӳ㣬����������Ϊ6����CΪO��Ԫ�أ�E��Cͬ���壬��EΪSԪ�أ�Ԫ��A��B�γɵ���̬���������10e�����ռ乹��Ϊ�����Σ���BΪNԪ�أ���ΪNH3�� D��FΪ��������Ԫ�أ�������DԪ�ص��ҡ������������ת��ȫΪ��������ԭ��Ӧ��DΪAlԪ�أ����ΪAl��OH��3 �� �ҡ����ֱ�ΪAlO2����Al3+�е�һ�֣�������FԪ�ص��ҡ������������ת��ȫΪ������ԭ��Ӧ��FԪ��Ϊ��������Ԫ�أ���FΪFeԪ�أ���ΪFe���ʡ���ΪFe2+����ΪFe3+ �� ��1���������ΪNH3 �� �����ʽΪ�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��FΪFeԪ�أ�λ�����ڱ��е������ڵڢ��壻�ǽ�����O��S�����⻯���ȶ���H2O����H2S�����Դ��ǣ��������ڵڢ��壻���ڣ���3���ҡ����ֱ�ΪAlO2����Al3+�е�һ�֣����߷�Ӧ���ӷ���ʽΪ��Al3++3AlO2��+6H2O=4Al��OH��3�������Դ��ǣ�Al3++3AlO2��+6H2O=4Al��OH��3������4���������Ӿ��л�ԭ�ԣ������Ը�������������������ӣ����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O�����Դ��ǣ�5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O����5�������»�����FeS��Ksp=6��10��18 mol2L��2 �� �����½�1.0��10��5molL��1��Na2S��Һ�뺬FeSO4��Һ�������3��2��ϣ���Ϻ���Һ��c��S2����=
����2��FΪFeԪ�أ�λ�����ڱ��е������ڵڢ��壻�ǽ�����O��S�����⻯���ȶ���H2O����H2S�����Դ��ǣ��������ڵڢ��壻���ڣ���3���ҡ����ֱ�ΪAlO2����Al3+�е�һ�֣����߷�Ӧ���ӷ���ʽΪ��Al3++3AlO2��+6H2O=4Al��OH��3�������Դ��ǣ�Al3++3AlO2��+6H2O=4Al��OH��3������4���������Ӿ��л�ԭ�ԣ������Ը�������������������ӣ����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O�����Դ��ǣ�5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O����5�������»�����FeS��Ksp=6��10��18 mol2L��2 �� �����½�1.0��10��5molL��1��Na2S��Һ�뺬FeSO4��Һ�������3��2��ϣ���Ϻ���Һ��c��S2����= ![]() mol/L=6.0��10��6mol/L�����г���FeS���ɣ�������Һ��c��Fe2+����
mol/L=6.0��10��6mol/L�����г���FeS���ɣ�������Һ��c��Fe2+���� ![]() mol/L=10��12mol/L��������c��FeSO4����
mol/L=10��12mol/L��������c��FeSO4���� ![]() mol/L=2.5��10��12 mol/L�����Դ��ǣ����ڻ����2.5��10��12 mol/L��
mol/L=2.5��10��12 mol/L�����Դ��ǣ����ڻ����2.5��10��12 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����������֮��������ͼ��ʾ��ת����ϵ�� 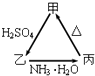
��1�������Dz�����ˮ�İ�ɫ��ĩ״���ʣ�������������������������������Һ����������ѧʽ���� д����Ӧ�Ļ�ѧ����ʽ
�ټס��� ��
���ҡ��� ��
��2��������Һ�м���KSCN��Һ����Ѫ��ɫ���֣�������������ѧʽ����д����Ӧ�����ӷ���ʽ�� �ټס��� ��
���ҡ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڣ�ʵ������Ӻ�������ȡ���������ͼ1�� 
��1����������ʱ�ǽ�������������������ƣ��У��þƾ��Ƴ�ּ��Ȼһ���
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ������� ��
��3����CCl4�ӵ�ˮ����ȡ�⾭�������ں��л��ܼ�������ϡ����¡����㣬�л����ɫ��
��4���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ����辭������ָ��ͼ2ʵ��װ���еĴ���֮���������� 
��
�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��������Ԫ�صĵ����ڳ����¶������壬X��Y��Z��Ӧ�ĵ��ʿ���������Ӧ������Ӧ��A��B��C�������ӣ�����B��C����10�����Һ�����ͬ��Ԫ��X��A��һ��������ˮ���ж����塣����֮�仹�������й�ϵ��
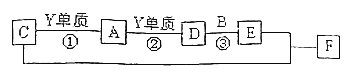
��ش��������⣺
��1��Z��ԭ�ӽṹʾ��ͼ________��C�ĵ���ʽΪ________��
��2����Ӧ�ڵ�����Ϊ______��д����Ӧ�۵Ļ�ѧ����ʽ_________________________
��3��������F�к��еĻ��ϼ�Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�����ǣ� ��
A.ԭ�ӵĺ�����Ӳ������ڸ�Ԫ�����ڵ�������
B.Ԫ�����ڱ��д�IIIB�嵽IIB��10�����е�Ԫ�ض��ǽ���Ԫ��
C.�������ϡ������ԭ�ӵ���������������8
D.ͬһԪ�صĸ���ͬλ�ص��������ʡ���ѧ���ʾ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ���Ľṹ��ʽΪCH2=CH-CH2OH�������Է����ķ�Ӧ�У���ȡ�������ӳɣ����Ӿۣ�����������ȼ�գ�������ȷ����
A.ֻ���٢ڢ�B.ֻ���ڢ�C.������D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԭ���װ��ʾ��ͼ��
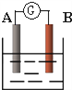
��1����AΪPb��BΪPbO2���������ҺΪH2SO4��Һ����ص��ܷ�ӦΪPb+PbO2+2H2SO4��2PbSO4+2H2O����õ���ڹ���ʱ��A�缫��������_______������ӡ�������С�����䡱�������õ�ط�Ӧ������0.1mol H2SO4����ת�Ƶ��ӵ���ĿΪ_______����NAΪ�����ӵ�������ֵ��
��2����A��B��Ϊ��Ƭ���������ҺΪKOH��Һ���ֱ��A��B����ͨ��CH4��O2���õ�ؼ�Ϊ����ȼ�ϵ�أ�д��A���ĵ缫��Ӧʽ��__________________________���õ�ع���һ��ʱ�����Һ�ļ��Խ�___________�����ǿ���������������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵������ȷ���ǣ� ��
A. ���³�ѹ�£�2 g D2O �к�������ΪNA
B. ����£�22.4L ������̼ԭ����Ϊ6NA
C. 2.4g Mg �ڿ����г��ȼ�գ�ת�Ƶĵ�����Ϊ0.2NA
D. 28g��ϩ�ͱ�ϩ��C3H6���Ļ�����庬�е�̼�����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����400mL ϡ�����м���һ�����������ۣ�������ȫ�ܽ�ų� NO���� 8.96L����״������ͬʱ��Һ�������� 13.2g�������ж���ȷ����
A. ��Ӧ�����Һ�� c(Fe2+)�Uc(Fe3+) =1�U2
B. ԭ��Һ��Ͷ���������ʵ����� 0.4 mol
C. ԭ��Һ�� HNO3 ��Ũ���� 4.0 mol/L
D. ��Ӧ�����Һ�л����ܽ� 4.8g ͭ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com