
����Ŀ�����б�������ȷ����( )

A. ����ͼ��֪�ϳɼ״����Ȼ�ѧ����ʽΪCO(g)+2H2(g)=CH3OH(g) ��H1=(b-a)kJ��mol-1
B. ͼ�ұ�ʾ2mol H2(g)�����е�������2mol��̬ˮ�����е�������483.6kJ
C. 1mol NaOH�ֱ��1mol CH3COOH��1mol HNO3��Ӧ�����߱�ǰ����HС
D. ����ȼ��ʱ��ȫ���Ļ�ѧ��ת��Ϊ����
���𰸡�C
��������
A�����ݼ�ͼ����Ӧ�����������������������������Ӧ�Ƿ��ȷ�Ӧ����H<0������H=(a��b)kJ��mol��1����A����B��ͼ�ұ�ʾ����2molH2(g)��1molO2(g)�����е�������2molH2O(g)�����е�������483.6kJ����B����C���кͷ�Ӧ�Ƿ��ȷ�Ӧ����H<0��CH3COOH�������ᣬ����������ȹ��̣�����Ϊǿ�ᣬ���1molNaOH��1molCH3COOH��Ӧ�ġ�H������1molHNO3��Ӧ�ġ�H����C��ȷ��D������ȼ���ǽ���ѧ��ת�������ܣ�ͬʱ������ܣ���D����


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ����Ԫ��ԭ�ӵĺ˵����������ԭ�Ӻ�������������������
A.8B.19C.16D.9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2 L�ĺ����ܱ������г���6molCO2 ��8molH2��������ӦCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H= -49.0kJmol-1�����n(H2)��ʱ��ı仯�����ߢ���ʾ������˵����ȷ����
CH3OH(g)+H2O(g) ��H= -49.0kJmol-1�����n(H2)��ʱ��ı仯�����ߢ���ʾ������˵����ȷ����
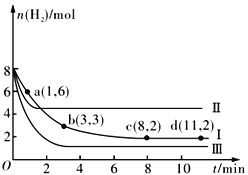
A. �÷�Ӧ��0~8 min��CO2 ��ƽ����Ӧ������0.375mol��L-1��min-1
B. �����¶Ȳ��䣬����ʼʱ�����������г���4molCO2��2molH2��2molCH3OH(g)��1mol H2O(g)�����ʱ��Ӧ������Ӧ�������
C. �����¶Ȳ��䣬����ʼʱ�����������г���3molCO2 ��4molH2����ƽ��ʱH2 �������������20%
D. �ı������õ����ߢ������ߢ�ı�������ֱ��������¶ȡ����뺤��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵؿ�����Ҫ��NaIO3����ʽ���ڣ��ں�ˮ����Ҫ��I����ʽ���ڣ���������֮���ת����ϵ��ͼ��ʾ����֪���������ʵ����������˵������ȷ����

A. ��I����Һ��ͨ��Cl2��������Һ���������Һһ������
B. ;��II��������1 mol I2������1 mol NaHSO3
C. �����Ե�ǿ��˳��ΪCl2>I2>IO3
D. һ�������£�I��IO3��������I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�������ʾ�����ͬһ��Ԫ��X������֮��������ת����ϵ��
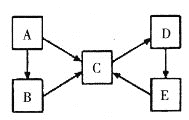
(1)��AΪ���ʣ���B��C�������࣬��A��B��C��Ԫ��X�Ļ��ϼ��������ߣ�C��D��E��Ԫ��X�Ļ��ϼ���ͬ����D����ɫΪ__________��E������Ϊ____________��
(2)��AΪ���ʣ�B��C���������࣬��B��C��ˮ��Һ�к�XԪ�ص��������������֮��Ϊ3��1��D��һ�ְ�ɫ��������Ԫ��X�����ڱ��е�λ����____________��A��C�ķ�Ӧ���������Ļ�ѧʽΪ___________��C��D��Ӧ�����ӷ���ʽΪ__________________________________��
(3)��A~E��Ϊ�����A�ǵ���ɫ���壬C��D��E���������࣬D��E��C���ҹ���ѧ�ҷ����ľ��乤ҵ�Ʊ�C�ķ�������A�ĵ���ʽΪ___________��D��E�Ļ�ѧ����ʽΪ��____________________________________��
(4)��AΪ���ʣ�C��D����Է����������16��B��E������Ӧֻ����һ�ֲ�����������ࡣ��B��C�Ļ�ѧ����ʽΪ____________________________��E��C_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ����MnO2��40 mL 10 mol��L��1��Ũ�����ַ�Ӧ�����ɵ�����������Ϊ0.1NA
B. �����£�224 mL H2O����������������ĿԼΪ0.02NA
C. 0.1mol FeCl3ˮ���γɵ�Fe(OH)3����������Ϊ0.1 NA
D. �����£�1 L pH��11��Na2CO3��Һ����ˮ�������H+��ĿΪ0.001NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֱ���ж������Ȼ�ѧ����ʽ��д����ȷ����( )
A. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)��H=-91.5 kJ/mol
HCl(g)��H=-91.5 kJ/mol
B. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)��H=+91.5 kJ/mol
HCl(g)��H=+91.5 kJ/mol
C. H2(g)+Cl2(g)![]() 2HCl(g) ��H=-183 kJ/mol
2HCl(g) ��H=-183 kJ/mol
D. 2HCl(g)![]() H2(g)+Cl2(g) ��H=+183kJ/mol
H2(g)+Cl2(g) ��H=+183kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܷ�����Ӧ��һ��������
A.NH3��HClB.N2��O2C.H2��COD.CO2��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�У�AΪһ�ֳ����ĵ��ʣ�B�� C�� D�� E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ��Ϊ��ɫ��

����д���пհף�
(1)д����ѧʽ��A____________��B____________��D____________��
(2)���Ϸ�Ӧ�У�����������ԭ��Ӧ����____________(��д���)��
(3)A��C��Ӧ�����ӷ���ʽ��____________________��
(4)E��D��Ӧ�Ļ�ѧ����ʽ��__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com