
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
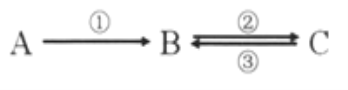
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
【答案】Fe+2Fe3+=3Fe2+ 取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+ SiCl4 ① ③ 2C+SiO2![]() Si+2CO↑
Si+2CO↑
【解析】
(1)由转化关系可知A为变价金属,则A应为Fe,B为氯化铁,C为氯化亚铁,②为Fe与氯化铁的反应;
(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,③中SiCl4与氢气反应,提纯Si,以此解答该题。
(1)A是常见的金属,①③中均有同一种气态非金属单质参与反应,且②为化合反应,则该非金属气体为Cl2,B为氯化铁,则反应②的离子方程式为2Fe3++Fe=3Fe2+;
(2)由分析知C为氯化亚铁,检验Fe2+的操作方法是取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+;
(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,其中②为Si和Cl2化合生成SiCl4,③中SiCl4与氢气反应,提纯Si,则反应①的化学方程式为SiO2+2C![]() Si+2CO↑,其中属于置换反应的有① ③。
Si+2CO↑,其中属于置换反应的有① ③。


科目:高中化学 来源: 题型:
【题目】向含 S2-、 Fe2+、 Br -、 I-各 0.1 mol 的溶液中通入 Cl2, 通入 Cl2 的体积(标准状况) 和溶液中相关离子的物质的量的关系图正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如图1所示。R位于第三周期,Z、M的最高价氧化物对应的水化物分别为甲、乙。常温下,0.1molL﹣1的甲溶液的pH为1.回答下列问题:

(1)R的某种氧化物为淡黄色固体,写出该氧化物的一种用途:_____。
(2)单质Y与乙的浓溶液共热产生两种无色气体,现用图2的装置检验这两种气体。B中试剂名称为_____;C中酸性KMnO4溶液的作用为_____。若C中溶液颜色褪尽,D中澄清石灰水变浑浊,则此现象不能证明产物中_____(化学式)气体的存在。
(3)写出铜和甲的稀溶液反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯容易发生聚合生成二聚体,该反应为:2![]()
![]()
![]() ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是
ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是

A.T1<T2
B.a点的正反应速率大于b点的逆反应速率
C.达平衡后,T1温度下环戊二烯的浓度大于T2温度下环戊二烯的浓度
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是
A.用石墨电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.明矾可以做净水剂:Al3++3H2O=Al(OH)3↓+3H+
C.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
D.向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是![]()
①稀豆浆、硅酸、氧化铁溶液都属于胶体
②纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
③明矾、冰水混合物、四氧化三铁都不是混合物
④![]() 、MgO、
、MgO、![]() 均属于碱性氧化物
均属于碱性氧化物
⑤葡萄糖、油脂都不属于有机高分子
⑥电解熔融的![]() 可制得金属铝
可制得金属铝
A.①②B.②③C.③⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法不正确的是( )
A. 某温度下,Ba(OH)2溶液中Kw=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B. 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-可能大量存在
C. 往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入,![]() 不断减小
不断减小
D. 一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末(不考虑热效应),则溶液中c(Ca2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时纯水中存在电离平衡:H2OH++ OH-。下列叙述正确的是
A.升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性
B.向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L
D.向水中加入少量 NH4Cl 固体,![]() 结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com