
| A. | 常温常压下,11.2 LSO2含有的氧原子数均为1.5NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 23g Na在化学反应中失去的电子数目为NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、求出氨气的物质的量,然后根据1mol氨气中含4mol原子来分析;
C、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析;
D、体积V=$\frac{N}{{N}_{A}}{V}_{m}$.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L二氧化硫的物质的量小于0.5mol,则含有的原子个数小于1.5NA个,故A错误;
B、17g氨气的物质的量为1mol,而1mol氨气中含4mol原子,即含4NA个,故B正确;
C、23g钠的物质的量为1mol,而反应后钠元素变为+1价,故1mol钠失去1mol电子即NA个,故C正确;
D、体积V=$\frac{N}{{N}_{A}}{V}_{m}$=$\frac{{N}_{A}}{{N}_{A}}×22.4$=22.4L,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
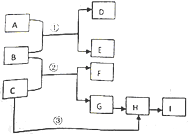 下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.
下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
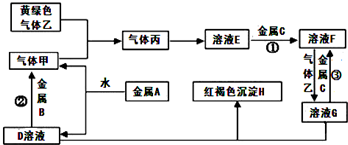 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al元素最高化合价依次升高 | B. | P、S、Cl原子半径依次减小 | ||
| C. | N、O、F元素非金属性依次减弱 | D. | Li、Na、K原子的电子层数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O,c(NH4+)由大到小的顺序是:④>③>②>① | |
| B. | 常温时,将等体积的盐酸和氨水混合后pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (CO32-)+c (HCO3-)+c (H2CO3)=0.2 mol•L-1 | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到酸性溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| Ⅰ | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| Ⅱ | 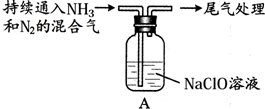 | 液面上方出现白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com