
下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠溶液与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO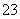 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO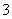 )>c(H+)
)>c(H+)
科目:高中化学 来源: 题型:
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) |
|
| C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+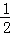 O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
|
| A. | 等于0.3mol | B. | 等于0.15mol |
|
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1和表(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
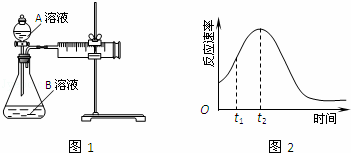
(1)写出草酸溶于水的电离方程式: .
(2)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=).
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(5)小组同学发现反应速率总是如2图,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、② .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种情况下一定能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO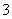
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO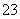 、Cl-、K+
、Cl-、K+
C.pH=1的溶液中:NH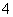 、Cl-、Cu2+、SO
、Cl-、Cu2+、SO
D.无色溶液中:Al3+、HCO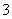 、I-、K+
、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其Ksp=cm(An+)·cn(Bm-),称为难溶电解质的溶度积。25 ℃时,向AgCl的白色悬浊液中依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知所有的物质的颜色和溶度积如下表:
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25 ℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25 ℃时,饱和AgCl、AgI、Ag2S溶液中Ag+的浓度相同
D.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________________________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com