
����Ŀ���ס������ص缫���϶���������̼��(��ͼ)����ش��������⣺

��1���������о�ʢ��CuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������ǣ��׳��е�_____�����ҳ��е�____����
�����ҳ��������ĵ缫��Ӧ��____________��
��2���������о�ʢ�ű���NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ��___________________��
����ʪ��ĵ���KI��ֽ�����ҳظ�����������ֽ��������һ��ʱ����ַ�����ɫ��ȥ��������Ϊ������Cl2�����ɵ�I2����������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5:1�������������ᡣ�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
���𰸡� C Fe 4OH--4e-=2H2O+O2�� 2C1-+2H2O![]() H2��+Cl2��+2OH- 5Cl2+I2+6H2O=10HCl+2HIO3
H2��+Cl2��+2OH- 5Cl2+I2+6H2O=10HCl+2HIO3
����������1����Ϊԭ��أ�FeΪ��������Ϊ���أ��ɵ��������֪��CΪ������FeΪ������ͭ���ӵõ���������Cu�����������������ӷŵ磻
��2���ҳ��ǵ��أ��ɵ��������֪��CΪ��������Һ��������ʧ���ӷ���������Ӧ����������FeΪ��������Һ�������ӵõ����ӷ�����ԭ��Ӧ�������������ݵ�ʧ���������ȷ��������ٸ��ݷ�Ӧ���������д����Ӧ����ʽ��
��1���ټ�Ϊԭ��أ�FeΪ������̼Ϊ������ͭ���ӷŵ�����ͭ������̼�缫�����ɺ�ɫ����Cu����Ϊ���أ��ɵ��������֪��FeΪ������ͭ���ӵõ���������Cu��
�����ҳ��������������ŵ磬�缫��Ӧ��4OH--4e-=2H2O+O2����
��2�����ҳ��ǵ��أ��ɵ��������֪��CΪ��������Һ��������ʧ���ӷ���������Ӧ����������FeΪ��������Һ�������ӵõ����ӷ�����ԭ��Ӧ�����������ܷ�ӦʽΪ2C1-+2H2O![]() H2��+Cl2��+2OH-��
H2��+Cl2��+2OH-��
�ڹ���Cl2�����ɵ�I2��������Cl2��I2��Ӧʱ�����ʵ���֮��Ϊ5��1���������������ᣬ��������ԭ���������ӣ�1mol��������ԭ�õ�2mol���ӣ����ݵ�ʧ���������֪����������е�Ļ��ϼ���+5�ۣ����Ժ�������ǵ��ᣬ�������͵⡢ˮ��Ӧ��������͵��ᣬ��Ӧ����ʽΪ5Cl2+I2+6H2O=10HCl+2HIO3��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����HA��Һ�еμ�NaOH��Һ����Һ��HA��A�������и�����ռ�����ʵ�������(��)����ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
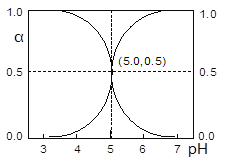
A. ��pH=5.0����Һ�У�c(A��)=c(HA)��c(OH��)= c(H+)
B. pH=7����Һ�У���(HA)=0����(A��)=1.0
C. 25��ʱ��Ka(HA)=1��10��5
D. pH=5.0ʱ����Һ��ˮ���������c(H+)=1��10��5mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���׳ص��ܷ�ӦʽΪ��CH4+2O2+2KOH=K2CO3+3H2O������˵����ȷ���ǣ������� 
A.�׳��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ҡ������ǻ�ѧ��ת�����ܵ�װ��
B.�׳��������ĵ缫��Ӧʽ��O2+4e��+4H+=2H2O
C.��Ӧ�����У��ҳص�pH��С
D.�׳�������O2����������������������������ͬ�����µı�ֵΪ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪����Fe(s)+![]() O2(g)=FeO(s) H1=-272.0kJ/mol
O2(g)=FeO(s) H1=-272.0kJ/mol
��2Al(s)+![]() O2(g)=Al2O3(s) H1=-1675.7kJ/mol
O2(g)=Al2O3(s) H1=-1675.7kJ/mol
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��__________________��ijͬѧ��Ϊ�����ȷ�Ӧ�����ڹ�ҵ����������ж���_____(������������������)��������________��
(2)��Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ��������µķ�Ӧ���̷ֱ�ΪA��B��ͼ��ʾ��
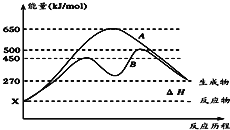
����ͼ�жϸ÷�Ӧ��_______(����������������)�ȷ�Ӧ��
������B���̱����˷�Ӧ���õ�����Ϊ________(����ĸ)��
A.�����¶� B.����Ӧ���Ũ�� C.�����¶� D.ʹ�ô���
(3)���ȷ��dz��õĽ�����������֮һ����֪��
4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
Mn(s)+O2(g)=MnO2(s)H=-521kJ/mol
Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��___________________��
(4)�й�����ֵ�������ʾ��2013�����ƽ����������Ϊ52����֮��γ���������Ҫ�ɷ�Ϊ�����������ŷŵķ���������β�����ﳾ�ȡ���CH4������������β���е����������Ⱦ��
��֪��CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
2NO2(g)=N2O4(g) H=-56.9kJ/mol
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ���CO2Ϊԭ�Ͽɺϳɶ����л��
��1��CO2�����������״�����֪��2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X(X=n(H2)/n(CO2))��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
CH2=CH2(g)+4H2O(g) ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X(X=n(H2)/n(CO2))��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��

��X1_______X2���>����<������ͬ����Q_______0��
��ͼ��A��B��C�����Ӧ��ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ______��
��TKʱ���ڸ��ݻ��ɱ�ĺ�ѹ�ܱ������з���������Ӧ������й��������±���ʾ��
���ʵ���(mol) ʱ��(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
��֪��10minʱֻ�ı���һ����Ӧ�������øı������������______��
������������ܱ����÷�Ӧ�ﵽƽ��״̬����_____��
a.�����ܶȲ��� b.������ݵ�ƽ��Ħ���������� c.�������ʣ�2v(H2O)=v(CO2)
��3�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
�� ��ij�β���õ�pH=10����Һ������Һ��c(CO32-):c(HCO3-)=______ �۳�����K1(H2CO3)=4.4��10-7��K2(H2CO3)=5��10-11�ݡ�
�� ����5L Na2CO3��Һ��23.3 g BaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ_________��[��֪��������Ksp(BaSO4)=1��10-7��Ksp(BaCO3)=2.5��10-6]����������Һ������ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.û�е��ʲμӵĻ��Ϸ�ӦҲ������������ԭ��Ӧ
B.���е������ɵĻ�ѧ��Ӧһ����������ԭ��Ӧ
C.������ֻ�ܵõ��ӱ���ԭ��������ֻ��ʧ���ӱ�����
D.��������������ԭ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥij���������������ʣ��ܼ���ͬѧ������������ʵ�飬��������ѡ�õ��Լ������������ȷ���ǣ� ��
��� | ���� | ���� | �����Լ���������� |
�� | NaCl��Һ | Na2CO3 | �������ᣬ���� |
�� | FeSO4��Һ | CuSO4 | ����������۲����� |
�� | H2 | CO2 | ����ͨ��ʢ��NaOH��Һ��Ũ�����ϴ��ƿ |
�� | NaNO3 | CaCO3 | ��ϡ�����ܽ⡢���ˡ��������ᾧ |
A.�٢ڢ�
B.�ڢۢ�
C.�٢ۢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��
��2����Ӧ����Ӧ����ѡ����ȡ������ȣ���
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� �� a��������ѹǿ���� b�����������c��CO������
c��v����H2��=v����H2O�� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��CH2��=c��CO��c��H2O�������жϴ�ʱ���¶�Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol̼����������ȫȼ���������壬�ų�393kJ�������������Ȼ�ѧ����ʽ��ʾ��ȷ����
A.C (s) +1/2O2 (g) = CO(g) ��H����393kJ��mol��1
B.C + O2 = CO2 ��H����393kJ��mol��1
C.C (s) + O2 (g)=CO2 (g) ��H��+393kJ��mol��1
D.C(s)+O2(g)=CO2(g) ��H����393kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com