
 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
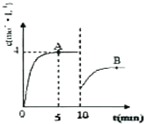
(2)由反应速率为单位时间内浓度的变化量来计算氨气的反应速率,再利用反应速率之比等于化学计量数之比计算氢气的反应速率;由图可知10min时氨气的浓度瞬间减小,平衡常数为生成物浓度幂之比与反应物浓度幂之比的比,温度不变,则化学平衡K不变;
(3)①平衡常数随温度变化,与压强和浓度变化无关,平衡常数变化结合反应一定原理分析判断;
②直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(4)依据化学三行计算列式计算物质的平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积.
解答 解:(1)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
由盖斯定律③×3-②×2+①×2得到热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol;
(2)由图可知10min时氨气的浓度瞬间减小,则采取的措施为移去部分氨气,因A和B点的温度相对,则化学平衡常数K相等,
故答案为:移去部分氨气;=;
(3)①在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,K1>K2;
故答案为:>;
②平衡标志最根本的依据是正反应速率等于逆反应速率,反应混合物中各组分的含量保持不变;
A、速率之比等于系数之比,2VH2(正)=3VNH3(逆),说明氨气的正反应速率等于氨气的逆反应速率,反应达到平衡,故A符合;
B、速率之比等于系数之比,v正(N2)=3v逆(H2)不符合速率之比等于系数之比,故B不符合;
C.容器内压强保持不变,反应前后气体体积减小,压强不变,说明平衡不变,故C符合;
D.反应体系中 物质质量守恒,体积相同,密度不变,反应进行过程中,平衡状态混合气体的密度保持不变,故D不符合;
故答案为:AC;
(4)N2(g)+3H2(g)═2NH3(g)
起始物质的量浓度(mol/L) 0.6 1.6 0
转化物质的量浓度(mol/L) 0.2 0.6 0.4
平衡物质的量浓度(mol/L) 0.4 1 0.4
k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=$\frac{0.{4}^{2}}{0.4×{1}^{3}}$=0.4(L/mol)2,
故答案为:0.4(L/mol)2.
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学反应能量变化图象分析,平衡标志、平衡常数和平衡计算的判断计算是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 标准状况下,2.24LCl2溶于足量NaOH中转移电子的数目为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
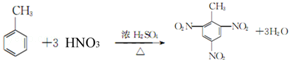
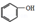 (制酚醛树脂)④
(制酚醛树脂)④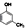 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)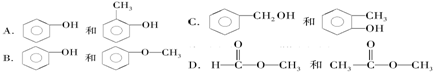
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com