
| A. | 肯定不含I- | B. | 可能含有Cu2+ | C. | 一定含有SO32- | D. | 肯定不含有NH4+ |
分析 溶液是无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-.
解答 解:溶液是无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-;分析判断可知,溶液中一定含有SO32-,一定不含Cu2+,可能含有I-,电荷守恒分析铵根离子一定存在;
A.加入的少量溴水,已知还原性SO32->I-,溴单质只氧化SO32-,溶液为无色,所以I-可能含有,溶液中可以含有I-,故A错误;
B.溶液是无色,肯定不含Cu2+,故B错误;
C.原溶液中一定含有SO32-,故C正确;
D.据电荷守恒分析铵根离子一定存在,故D错误;
故选C.
点评 本题考查了氧化还原反应的应用、离子反应,题目难度不大,把握氧化还原反应中反应的先后顺序以及常见有色离子是解题关键,侧重于考查学生的分析能力和对基础知识的应用能力.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光明暗程度变化不明显 | D. | 灯光变亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
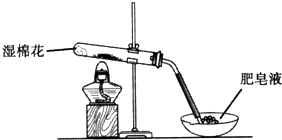 某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.
某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
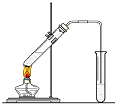 在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
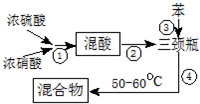
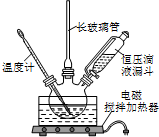 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图: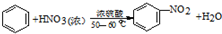
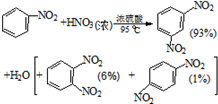
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com