
| A. | H+ | B. | SO42- | C. | OH- | D. | Na+ |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 某蓝色溶液中加NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ | |
| B. | 某溶液中加BaCl2溶液,生成白色沉淀,继续滴加稀硝酸沉淀不溶解,说明原溶液中有SO42- | |
| C. | 某溶液中加硝酸银溶液,生成白色沉淀,继续滴加稀硝酸有部分沉淀不溶解,说明原溶液中一定有Cl- | |
| D. | 某溶液中加稀硫酸溶液生成无色无味气体,该气体能使澄清石灰水变浑浊,说明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑧ | B. | ②③④⑤⑥⑦ | C. | ③⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
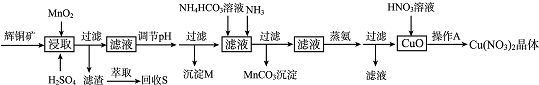
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com