

分析 A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20;A和E属同一族,它们原子的最外层电子排布为ns1,属于第IA族元素,A不是金属元素,则A是H元素;
B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,则二者为第VIA族元素,B原子序数小于D,则B是O元素、D是S元素;
C原子最外层电子数等于D原子最外层电子数的一半,则C原子最外层电子数是3,为第IIIA族元素,E为金属元素,在C是Al元素;
E原子序数大于S且原子序数小于20,为第IA族元素,则E为K元素;
(1)由这五种元素组成的一种化合物是明矾;
(2)C元素是Al元素,其原子核外有13个电子,根据构造原理书写Al原子基态原子的电子排布式;
(3)D是S元素,其价电子为3s、3p电子,3s能级上有2个电子、3p能级上有4个电子;
(4)同一主族元素,元素的电负性随着原子序数增大而减弱;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,同一主族元素,第一电离能随着原子序数增大而减弱.
解答 解:A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20;A和E属同一族,它们原子的最外层电子排布为ns1,属于第IA族元素,A不是金属元素,则A是H元素;
B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,则二者为第VIA族元素,B原子序数小于D,则B是O元素、D是S元素;
C原子最外层电子数等于D原子最外层电子数的一半,则C原子最外层电子数是3,为第IIIA族元素,E为金属元素,在C是Al元素;
E原子序数大于S且原子序数小于20,为第IA族元素,则E为K元素;
(1)由这五种元素组成的一种化合物是明矾,化学式为KAl(SO4)2.12H2O,故答案为:KAl(SO4)2.12H2O;
(2)C元素是Al元素,其原子核外有13个电子,根据构造原理书写Al原子基态原子的电子排布式为1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(3)D是S元素,其价电子为3s、3p电子,3s能级上有2个电子、3p能级上有4个电子,其价电子排布图为 ,故答案为:
,故答案为: ;
;
(4)同一主族元素,元素的电负性随着原子序数增大而减弱,原子序数O<S,所以电负性O>S;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,同一主族元素,第一电离能随着原子序数增大而减弱,所以第一电离能Al>Na>K,则第一电离能Al>K,
故答案为:O>S;Al>K.
点评 本题考查位置结构性质相互关系及应用,侧重考查原子核外电子排布、电离能、电负性等知识点,正确判断元素是解本题关键,注意第一电离能的元素周期律及异常现象和原因,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}Br$ | |
| C. | 硫离子的结构示意图: | |
| D. | NH3 的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有吸水性 | |
| B. | 浓硝酸保存在棕色的细口瓶中,并置于低温阴暗处 | |
| C. | 铵盐都不稳定,受热分解都生成氨气 | |
| D. | 向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.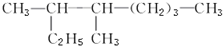 3,4-二甲基-庚烷.
3,4-二甲基-庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.
,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 mol/(L•s) | B. | 0.8mol/(L•s) | C. | 1.6 mol/(L•s) | D. | 0.08 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com