


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、随原子序数的递增,第三周期元素的电负性逐渐减小 |
| B、在所有的元素中,氟的电负性最大 |
| C、在所有的元素中,氟的第一电离能最大 |
| D、铝的第一电离能比镁的第一电离能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.
四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.查看答案和解析>>
科目:高中化学 来源: 题型:
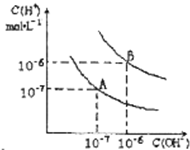 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
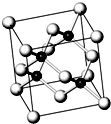 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
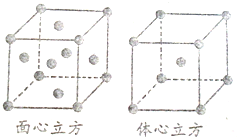 (1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为
(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热的反应一定是吸热反应 |
| B、所有的化学反应都有能量变化 |
| C、所有的放热反应都可以在常温常压下自发进行 |
| D、核能作为一种反应热,是理想的新能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com