
【题目】工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
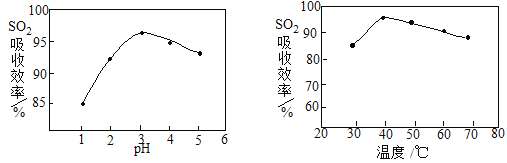
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
【答案】(1)b(2)pH控制在3左右,温度控制在40℃左右。(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (4)取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽。(5)n(S2O32-)= 5.00×10-3mol·L-1 × 12.0 mL= 6.00×10-5 mol
O2 ~ 4 S2O32-
1 mol 4 mol
n(O2) 6.00×10-5 mol
n(O2)=1.50×10-5 mol
水样中溶解氧的浓度=1.50×10-5 mol × 32 g·mol-1÷100mL=4.80 mg·L-1
【解析】
试题分析:(1)分析题给流程和信息知该工艺流程是用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O,物质X若用盐酸和硝酸会引入杂质离子,最好选用硫酸,选b。(2)读图可知,其它变量保持不变时,酸浸溶液pH为3左右时,二氧化硫的吸收率最大;其它变量保持不变时,酸浸溶液温度为40℃左右时,二氧化硫的吸收率最大;为了提高二氧化硫的吸收率,酸浸适宜的条件是pH为3左右、温度为40℃左右。(3)浸出液中阳离子主要有Mn2+、Fe2+、Al3+等,流程中“氧化”步骤是二氧化锰将Fe2+氧化为Fe3+,主要反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。(4) Fe3+与KSCN溶液反应溶液变红色,故检验Fe3+是否除尽的最佳方法是取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽。(5)根据反应方程式的推导已知量和要求量之间的关系式,代入数据进行计算。详解见答案。


科目:高中化学 来源: 题型:
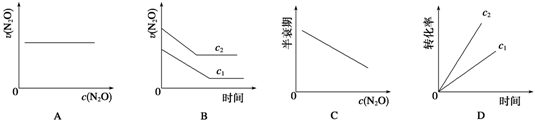
【题目】在一定条件下,N2O分解的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(N2O)/mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
反应时间/min | 60 | 70 | 80 | 90 | 100 | |
c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是 ( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件中最佳组合是①纯锌片;②粗锌片;③0.01 mol/L盐酸;④0.01 mol/L硫酸;⑤98%硫酸;⑥加热;⑦用冰水冷却( )
A. ①③⑦ B. ②④⑥ C. ②③⑥ D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生化学反应,其化学反应类型属于加成反应又叫还原反应的是( )
A. 氢气和苯 B. 乙炔和氯化氢 C. 乙醇和浓硫酸 D. 甲烷和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是 ( )
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:v正<v逆
C.若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D.0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
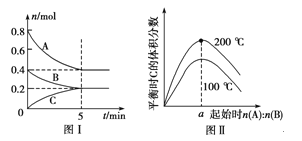
A.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______________;
______________; ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A. 冰醋酸、纯碱、铜绿、生石灰分别属于酸、碱、盐、氧化物
B. HClO、H2SO4(浓) 、HNO3均具有强氧化性,都是氧化性酸
C. Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物
D. H2SO4、NaOH、AlCl3均为强电解质,都属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B为原料制备线型高分子化合物M和抗凝血药N的一种路线如下(部分反应条件和试剂略去):

已知:I. 烃A的密度是相同条件下H2密度的14倍;
I.![]()
II. ![]()
请回答下列问题:
(1)B的化学名称为____。F的结构简式为______。
(2)N中含氧官能团的名称为 _______。
(3)D→E的反应类型为_____。
(4)I的核磁共振氢谱中有_______组吸收峰。G分子中最多有____个原子共平面。
(5)B+C→M的化学方程式为_______。
(6)同时满足下列条件的J的同分异构体有_____种(不考虑立体异构)。
①苯环上连有2个取代基
②1mol该物质与足量的NaHCO3反应,生成2molCO2
(7)参照上述信息和合成路线,以HO![]() CH3和(CH3CO)2O为起始原料(其他无机试剂任选),设计制备
CH3和(CH3CO)2O为起始原料(其他无机试剂任选),设计制备![]() 的合成路线 _______。
的合成路线 _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com