
【题目】物质的用途与物质的化学性质有关的是( )
A. 用醋酸除去水垢
B. 干冰用作冷冻剂
C. 活性炭用作除味剂
D. 制作馒头时加入小苏打
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( )
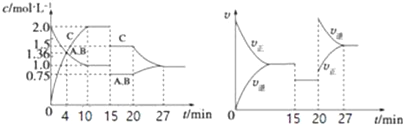
A. 4 min时反应第一次达到平衡
B. 15 min时降低压强,20 min时升高温度
C. 反应方程式中的x=1,正反应为吸热反应
D. 15~20 min该反应使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)82Pb的原子结构示意图为 。铅蓄电池的正极材料为_________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ____倍。(保留三位有效数字)。
(3)古代用PbSO4作油画的白色颜料,置于空气会慢慢变成黑色的PbS,从而使油画色彩变暗。用H2O2清洗可使油画“复原”。用化学方程式表示该复原的原理________。
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(4)滤液X是一种可循环使用的物质,其溶质主要是__________________(填化学式),若X中残留的![]() 过多,循环使用时可能出现的问题是___________________________。
过多,循环使用时可能出现的问题是___________________________。
(5)向 PbSO4中加Na2CO3溶液会发生:PbSO4 (s)+ ![]() (aq)
(aq)![]() PbCO3 (s)+
PbCO3 (s)+ ![]() (aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在 极生成(填“阴”或“阳”);而另一极的电极反应式为 ,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。
实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1) 装置A中发生反应的离子方程式为_________________________________。
(2) 装置B的作用为__________________________________________,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为_____________________________。
(3) 仪器D的名称为__________________,E中冷凝水的的入口是____________(填“a”或“b”),F的作用为_____________________。
(4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为___________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是________
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6) 长期存放的硫酰氯会发黄,其原因可能为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
A. 1:6 B. 2:3 C. 3:2 D. 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素-4是一种激光染料,应用于可调谐染料激光器。香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示。下列有关叙述正确的是
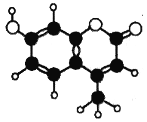
①分子式为![]()
②能与饱和溴水发生取代反应
③能与饱和溴水发生加成反应
④能使酸性![]() 溶液褪色
溶液褪色
⑤1mol香豆素-4最多能与含1molNaOH的溶液反应
A. ①②③ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)铁元素在周期表中的位置是_______,基态Cu2+的核外电子排布式是__________。元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的杂化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测 NO3-的空间构型为____________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______, 原因是______________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,由此可知 FeCl3的晶体类型为______;S和Fe形成的某化合物,其晶胞如图一所示, 则该物质的化学式为__________。

(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为 _________(用含a 的式子表达,不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属单质的描述正确的是( )
A. 碱金属都可以保存在煤油中
B. 碱金属与水反应,均浮在水面上
C. 在空气中加热均可生成多种氧化物
D. 硬度小、密度小、熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com