
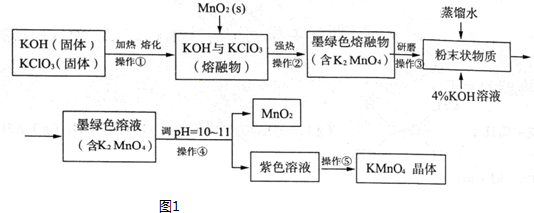
分析 在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,溶于水得墨绿色K2MnO4溶液,K2MnO4溶液中加入氢氧化钾溶液再调节PH值为10~11,使MnO42-发生歧化反应,生成MnO4-和MnO2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,
(1)在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,生成K2MnO4,同时还产生了KCl和H2O,根据元素守恒书写化学方程式;操作①和②中均有强碱性物质加热,所以不能用含有与碱反应的成份的坩埚,据此答题;
(2)操作④是使MnO42-发生歧化反应,生成MnO4-和MnO2,根据电荷守恒和元素守恒可书写离子方程式,若溶液碱性过强,则MnO4-又会转化为MnO42-和氧气,据此书写离子方程式,在调节PH值时,如果用盐酸会被高锰酸钾氧化成氯气,所以不能用盐酸调节PH值;
(3)抽滤与过滤相比,抽滤速度快、效果好,据此选择;
(4)电解K2MnO4溶液(绿色)的方法制造KMnO4,电解过程中右侧石墨电极为阳极,是K2MnO4发生氧化反应生成KMnO4电解较长时间后,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色).
解答 解:在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,溶于水得墨绿色K2MnO4溶液,K2MnO4溶液中加入氢氧化钾溶液再调节PH值为10~11,使MnO42-发生歧化反应,生成MnO4-和MnO2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,
(1)在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,生成K2MnO4,同时还产生了KCl和H2O,反应的化学方程式为,操作①和②中均有强碱性物质加热,所以不能用含有与碱反应的成份的坩埚,故选c,
故答案为:KClO3+3MnO2+6KOH $\frac{\underline{\;高温\;}}{\;}$ 3K2MnO4+KCl+3H2O↑;c;
(2)操作④是使MnO42-发生歧化反应,生成MnO4-和MnO2,反应的离子方程式为3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-,若溶液碱性过强,则MnO4-又会转化为MnO42-和氧气,反应的离子方程式为 3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-,在调节PH值时,Cl-具有还原性,可将K2MnO4和KMnO4还原,所以如果用盐酸会被高锰酸钾氧化成氯气,故不能用盐酸调节PH值,
故答案为:3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-;3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-;Cl-具有还原性,可将K2MnO4和KMnO4还原;
(3)抽滤与过滤相比,抽滤速度快、效果好,所以用抽滤不用过滤,
故答案为:过滤速度快、效果好;
(4)电解K2MnO4溶液(绿色)的方法制造KMnO4,电解过程中右侧石墨电极为阳极,是K2MnO4发生氧化反应生成KMnO4,电极反应式为MnO42--e-=MnO4-,电解较长时间后,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色),
故答案为:MnO42--e-=MnO4-;电解较长时间后,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色).
点评 本题考查了制备实验中的有关知识,难度不大,明确常用消毒剂的消毒原理、化学试剂的存放等知识点,易错题是④,注意锰酸钾和二氧化碳的反应中锰酸钾既作氧化剂又作还原剂.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.00 | 0.00 | 16.70 | 16.70 | 0.1044 |
| 2 | 16.75 | 0.00 | 17.85 | 17.85 | |
| 3 | 19.55 | 0.00 | 20.80 | 20.80 | 0.1064 |
| 4 | 15.00 | 0.00 | 16.00 | 16.00 | 0.1067 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
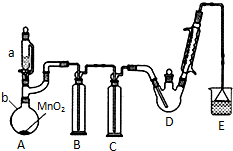 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
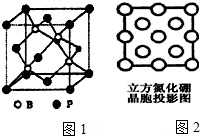 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 一种微粒与另一种微粒的质子数和电子数均相等,它们可能是一种离子和一种分子 | |
| D. | 不存在两种质子数和电子数均相同的阳离子和阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com