在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,
(1)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(2)判断氧化剂是______;______元素被氧化;被还原的HNO3与参加反应的HNO3物质的量之比是______.
(3)写出该反应的离子方程式:______.
解:(1)氧化还原反应3Cu+8HNO
3=3Cu(NO
3)
2+2NO↑+4H
2O中失电子的元素是铜元素,化合价升高,得电子的元素是氮元素,化合价降低,转移的电子数目为6mol,电子转移情况为:
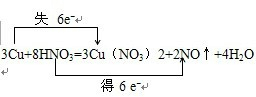
,
故答案为:
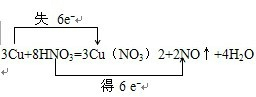
;
(2)反应中N元素化合价降低,HNO
3为氧化剂,Cu元素化合价升高,被氧化,根据方程式可判断,当8molHNO
3参加反应时,有2mol被还原,表现为氧化性,6molHNO
3表现为酸性,被还原的HNO
3与参加反应的HNO
3物质的量之比是1:4,故答案为:HNO
3;Cu;1:4;
(3)该反应的实质为Cu和NO
3-在酸性条件下发生氧化还原反应,反应的离子方程式为3Cu+8H
++2NO
3-=3Cu
2++2NO↑+4H
2O,
故答案为:3Cu+8H
++2NO
3-=3Cu
2++2NO↑+4H
2O.
分析:氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,化合价降低元素所在的反应物是氧化剂,化合价降低元素所在的生成物是还原产物;
该反应的实质为Cu和NO
3-在酸性条件下发生氧化还原反应.
点评:本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析,易错点为(1),注意双线桥法的运用.

 ,
, ;
;


