
【题目】辛烷(C8H18)是汽油的重要成分,其与O2反应的能量变化如图所示。下列判断正确的是
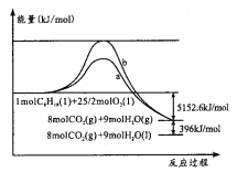
A. 曲线b代表加入催化剂时的能量变化
B. 反应物的总能量小于生成物的总能量
C. 表示辛烷燃烧热的热化学方程式:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-5152.6kJ/mol
D. 反应a、b的活化能不同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NH3 是一种重要的化工原料,工业上用 H2、N2合成。
(1)工业上由焦炭或天然气制氢气的过程中会产生一氧化碳。为了尽量除去氢气中混有的 一氧化碳,可在催化剂存在的条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
①在一个容积为 2L 的恒温密闭容器中加入 1molCO 和 3molH2O(g),发生上述反应,5min 后达到平衡,测得放出热量为 20.5kJ,则该时间段内反应的平均速率ν(CO)=______,此温度下该反应平衡常数 K=_____。该温度下在此容器中加入 3molCO 和 1molH2O(g)发生上述反应,达到平衡后放出热 量_____20.5kJ(填“>”、“=”或“<”)。
②已知不同反应物投料比(![]() )下,平衡混合气体中 CO 的体积分数如下表所示:
)下,平衡混合气体中 CO 的体积分数如下表所示:
温度(℃)\投料比 | 1 | 3 | 5 |
200℃ | 0.70 | 0.21 | 0.02 |
从表中数据分析可知:
反应物投料比越大,CO 的平衡转化率越________(填“大”或“小”); 请推测随反应物投料比增大,H2O的平衡转化率的变化趋势是______(填字母)。
A.增大 B.减小 C.先减小后增大 D.先增大后减小
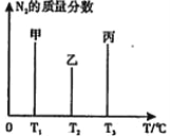
(2)用 2mol N2和3molH2合成氨,三容器的反应温度分别为 T1、T2、T3且恒定不变,在 其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是_____,都达到平衡状态时,N2转化率最低的是________。(用“甲”、“乙”、“丙”填空)
(3)NH3与CO2在120℃,催化剂作用下可以合成反应生成尿素: CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
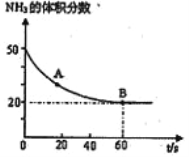
A 点的逆反应速率V逆(CO2)_____B 点的正反应速率 V正(CO2)(填“>”、 “=”或“<”);NH3的平衡转化率为____________。
(4)已知 NH2COONH4(s)![]() 2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液,当后一种溶液逐滴加入到一定量的前一种溶液中并稍过量,其溶液的导电性(I表示导电能力)与后一种溶液的质量(m)的函数关系符合下图的是
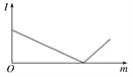
A. 澄清石灰水、碳酸钠溶液
B. 硝酸银溶液、氯化钠溶液
C. 盐酸、氢氧化钠溶液
D. 稀硫酸、氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的说法中,正确的是
A. 热稳定性:Na2CO3<NaHCO3
B. 相同温度下在水中的溶解度:Na2CO3<NaHCO3
C. 取1 mol·L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液
D. 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲测定铁铝合金的组成,将铁铝合金溶解后,取试样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚易挥发,易燃烧。
回答下列问题:
(1)常温下,将铁铝合金溶解的试剂是_________(填字母)。
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.浓硝酸
(2)已知氢氧化铁实际上是三氧化二铁的水合物,则通过称量氢氧化铁固体质量的方法来确定c(Fe3+)时,该方案理论上的主要缺点是________________________。
(3)操作X是___________________________,操作X后检验溶液中是否有Fe3+残留的方法是_______________________________。
(4)蒸馏装置如图所示,装置中存在的错误是___________________________。

(5)将含Fe3+的溶液定容至100mL需要的仪器是___________________________。
(6)已知滴定反应为Ce4++Fe2+=Ce3++Fe3+,当滴定达到终点时,消耗0.1000 mol·L-1Ce(SO4)2溶液15.00 mL,则开始试样中c(Fe3+)=_____________。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,则该过程的离子反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成H的两条途径如图:


回到下列问题:
(1)关于H说法正确的是_________(填标号)。
a.能使溴水褪色 b.1mol该物质最多能与3mol NaOH反应
c.属于芳香烃类物质 d.分子内最多有9个碳原子共平面
(2)C生成D的反应类型为____________,G的名称为____________。
(3)写出D生成E的化学方程式____________________________________。
(4)已知物质M与D互为同分异构体,M的水溶液呈酸性,在一定条件下2molM能生成1mol分子中含六元环结构的有机物,则M在铜的催化下与氧气反应的化学方程式为____________________________________________________________。
(5)满足下列所有条件的F(结构简式见已知)的同分异构体的数目有________种。
a.能发生银镜反应 b.苯环上有两个取代基
写出上述异构体中能使FeCl3溶液显紫色,核磁共振氢谱有五组峰且面积比为1:2:2:2:1的结构简式________________________。
(6)结合已有知识和信息并参照上述合成路线,以丙醇为起始原料(无机试剂任选),设计制备 的合成路线。_______________
的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
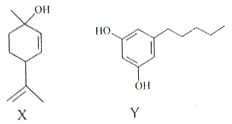
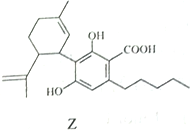
A. X分子中所有碳原子可处于同一平面 B. X、Z分子中均含有2个手性碳原子
C. 1molZ最多只能与2molBr2发生反应 D. X、Y、Z均可与NaOH稀溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)不溶于乙醇,20℃、80℃时溶解度依次为70.1、231g/100gH2O。可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4、Na2CO3等)及纯碱等为原料制备Na2S2O3·5H2O的实验流程如下:

(1)用Na2S2O3脱除纸浆中多余Cl2的离子反应方程式为__________。
(2)“净化”时加入的试剂X可能是__________ (填化学式)。
(3)“趁热过滤”时,用双层滤纸过滤的原因是__________。
(4)制备Na2S2O3的实验装置如下图所示:

①装置连接好并装入药品后,检验装置是否漏气的方法是__________。
②实验过程中打开螺旋夹并调节螺旋夹至适当的位置,一方面使反应产生的SO2气体较均匀地通入Na2S-Na2CO3溶液中,另一方面的作用是__________。
③请设计由三口烧瓶中的反应液制备Na2S2O3·5H2O的实验方案:拆解装置,__________,将固体放在40℃烘箱中干燥40min,制得Na2S2O3·5H2O(实验中须使用的试剂有:2mol·L-1NaOH溶液、95%乙醇)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com