
氮的化合物在生产生活中广泛存在。
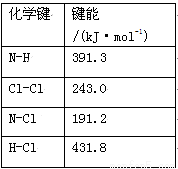
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
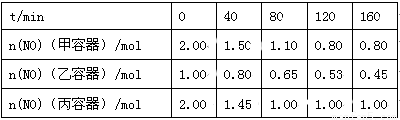
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:选择题
固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
A.12 B.16 C.20 D.25
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一6月月考化学试卷(解析版) 题型:选择题
某气态的烷烃与烯烃的混合气体9 g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为
A.甲烷,乙烯 B.乙烷,乙烯
C.甲烷,丙烯 D.甲烷,丁烯
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:实验题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
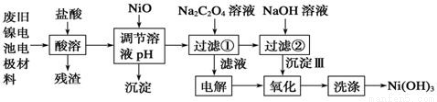
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。 H2O > NiC2O4
H2O > NiC2O4 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一
 Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一 Ni2O3+3 H2O
Ni2O3+3 H2O
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:选择题
NA表示阿伏加罗常数的值,下列有关叙述正确的个数为
①1mol苯乙烯中含有的碳碳双键数为4NA
②4.2g乙烯和丙烯混合气中含有的极性键数目为0.6NA
③标况下,3.36LHF含有的电子数为1.5NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥在KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应中,每生成1mol Cl2转移的电子总数为2 NA
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
A.3个 B.4个 C.5个 D.6个
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三下仿真二理综化学试卷(解析版) 题型:选择题
用Pt极电解含有Ag+、Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m (g)与回路中通过电子的物质的量n (mol)关系如图所示。则下列氧化性强弱的判断正确的是
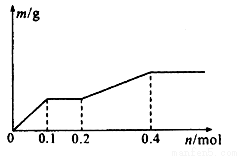
A.Ag+>X3+>Cu2+>H+>X2+
B.Ag+>Cu2+>X3+>H+>X2+
C.Cu2+> X3十>Ag十>X2+ >H+
X3十>Ag十>X2+ >H+
D.Cu2+>Ag+>X3+>H+>X2+
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺二理综化学试卷(解析版) 题型:填空题
由Ca3(PO4)2、SiO2、焦炭等为原料生产硅胶(SiO2•nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
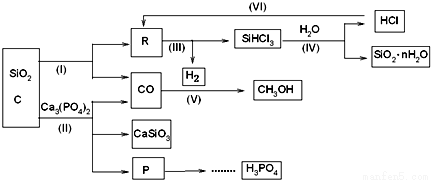
(1)上述反应中,属于置换反应的是___________[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)].
(2)高温下进行的反应Ⅱ的化学方程式为:___________;固体废弃物CaSiO3可用于___________;
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是___________;
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为___________;
(5)指出(Ⅵ)这一环节在工业生产上的意义___________;
(6)写出由P→H3PO4 有关反应式①___________,②___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安长安一中高二下第二次月考化学卷(解析版) 题型:选择题
已知如下反应:
 在水溶液中存在平衡:
在水溶液中存在平衡: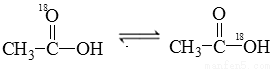 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
A. B.
B.
C. H2O  D. H218O
D. H218O
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三全真模拟二化学试卷(解析版) 题型:填空题
I.下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第______周期第___ ____族,
其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ;
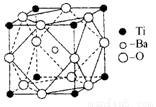
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有________生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com