
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是
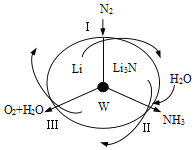
A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( )
A.钠在氧气中燃烧,钠的氧化产物:![]()
B.铁在Cl2中燃烧,铁的氧化产物:![]()
C.A1C13溶液中滴加NaOH溶液后体系中铝元素的存在形式:![]()
D.FeI2溶液中通入Cl2,铁元素存在形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
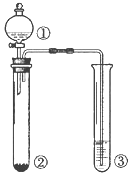
选项 | ① | ② | ③ | 实验结论 |
A | 浓氨水 | NaOH | 酚酞试液 | 碱性:NaOH>NH3·H2O |
B | 浓硫酸 | 蔗糖 | 品红溶液 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐反应均可生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是

A. 在0~50 min之间,R的降解百分率pH=2大于pH=7
B. 溶液酸性越强,R的降解速率越大
C. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
D. 在20~25 min之间,pH=10时R的降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
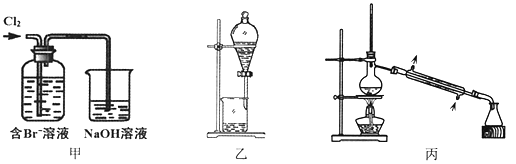
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的密闭容器中(体积不变)充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )

A.进行到3分钟时,正反应速率和逆反应速率相等
B.10分钟后容器中各物质浓度不再改变
C.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
D.10min内用H2的浓度变化表示的平均反应速率为0.075mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种染料敏化太阳能电池的示意图,电池的一个电极由有机光敏染料(R)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,下列关于该电池叙述不正确的是( )

A.染料敏化TiO2电极为电池负极,发生氧化反应
B.正极电极反应式是:I3-+2e-=3I-
C.电池总反应是:2R++3I-=I3-+2R
D.电池工作时将太阳能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙组同学分别做了以下探究实验。
(1)甲组探究![]() 与
与![]() 溶液反应,实验装置如下:
溶液反应,实验装置如下:

①请指出该装置的不足之处 ______ 、 ______ 。
②![]() 与
与![]() 溶液反应的离子方程式为 ______ 。
溶液反应的离子方程式为 ______ 。
③设计实验,简述实验步骤,证明洗气瓶中的![]() 已被氧化 ______ 。
已被氧化 ______ 。
(2)乙组探究乙酸乙酯![]() 沸点
沸点![]() 在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
试管Ⅰ | 试管Ⅱ | 试管Ⅲ | 试管Ⅳ | |
乙酸乙酯 | 1 | V1 | V2 | V3 |
| V4 | 3 | 0 | V5 |
蒸馏水 | 0 | V6 | 5 | 2 |
④请完成上表,其中![]() ______ ,
______ ,![]() ______ ,
______ ,![]() ______ 。
______ 。
⑤实验中,可用饱和食盐水替代蒸馏水,其优点是 ______ ;但不能用饱和![]() 溶液替代蒸馏水,其原因是 ______ 。
溶液替代蒸馏水,其原因是 ______ 。
⑥实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com