

���� ����W��������Һ������w�ǵⵥ�ʣ�X��Y��Ӧ���ɵ��Z��Z�������г��õĵ�ζƷ��Z���Ȼ��ƣ�����Ԫ���غ㡢������ԭ��Ӧ��X��W�ǵ��ʡ�Y��ZΪ������֪��X��������Y�ǵ⻯�ƣ�
����X�ǹ�ҵ���������Ľ������ʣ���X������Z��һ�־��д��Եĺ�ɫ���壬Z��������������X��Y��Z��W���������������ת����ϵ������X��W���ʣ�Y��ZΪ������÷�Ӧ������ˮ������Ӧ��������������������������W��������Y��ˮ��
��1�������£�����ˮ������Ӧ����������������������
��2���ٴ�ʵ�鰲ȫ�Է��������
��ʵ�������Ҫ��ֹ���ʵĸ��ţ���ʵ����Ҫ�г���װ�ã�
��3����ȷ����Һ�����ʳɷ֣��ٸ���ԭ���غ�����������Ƶ������
��� �⣺����W��������Һ������w�ǵⵥ�ʣ�X��Y��Ӧ���ɵ��Z��Z�������г��õĵ�ζƷ��Z���Ȼ��ƣ�����Ԫ���غ㡢������ԭ��Ӧ��X��W�ǵ��ʡ�Y��ZΪ������֪��X��������Y�ǵ⻯�ƣ�
��1��ͨ�����Ϸ���֪����FeCl2��Һ�м���Cl2��ˮ��Һ��ʹ��Һ��ɫ��Ϊ�ػ�ɫ��
�ʴ�Ϊ��Cl2��
��2����ҵ���õ�ⱥ���Ȼ�����Һ��ȡ�������ƣ���ⷽ��ʽΪ��2NaCl+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2NaOH��
�ʴ�Ϊ��2NaCl+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2NaOH��
��3��������ǿ�����ԣ��ܰѵ������������ɵ�������ӣ�ͬʱ��������ԭ�������ӣ����ӷ���ʽΪ��3Cl2+I-+3H2O�T6Cl-+IO3-+6H+��
�ʴ�Ϊ��3Cl2+I-+3H2O�T6Cl-+IO3-+6H+��
����X�ǹ�ҵ���������Ľ������ʣ���X������Z��һ�־��д��Եĺ�ɫ���壬Z��������������X��Y��Z��W���������������ת����ϵ������X��W���ʣ�Y��ZΪ������÷�Ӧ������ˮ������Ӧ��������������������������W��������Y��ˮ��
��1�����������£�����ˮ��Ӧ������������������������Ӧ����ʽΪ3Fe+4H2O$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2��
�ʴ�Ϊ��3Fe+4H2O$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2��
��2����������ԭ�������ʵ���У���Ϊ������������һ����Χ�ڻ������ը������ʵ��Ӧ������ȡ������Ȼ�����������ͨ��������ͨ��һ��ʱ����ٵ�ȼ�ƾ��ƣ�����ʵ��˳��Ϊb��c��a��
�ʴ�Ϊ��b c a��
�ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���������ӷ��ԣ�������ȡ�������к����Ȼ������壬Ϊ��ֹ�Ȼ����������ʵ�飬Ӧ���ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ��ϴ���Ȼ������壬
�ʴ�Ϊ���ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ��
��3�����������������ᷴӦ���������κ�NO������Һ�еμ�����������Һ�������κ��������Ʒ�Ӧ���ɳ����������ƣ�������Һ����������ӵ��������������Ƶ�Ũ�ȣ���������ʵ���=4mol/L��0.05L=0.2mol����ַ�Ӧ������112mL��NO�����ݵ�ԭ���غ㣬�����һ�����������ʵ���֮��Ϊ1��1������Һ��ʣ����������ʵ���=0.2mol-$\frac{0.112L}{22.4L/mol}$=0.195mol�������κ��������Ʒ�Ӧ���ɳ����������ƣ����������ƺ����������֮������ʵ���֮��Ϊ1��1�����������Ƶ����ΪV��
NaOH------NO3-��
1mol 1mol
2V 0.195mol
V=97.5mL��
�ʴ�Ϊ��97.5��
���� ������Ԫ�ػ�������ƶ�Ϊ���忼����Ԫ�ػ���������ʣ���ȷԪ�ػ����������ǽⱾ��Ĺؼ���ͬʱ����ѧ��˼ά�����������ƶ�������ע�⣨3�����и���ԭ���غ�����������Ƶ�����ϼ�㣬��ȷȷ�����ʼ��ɷ�������ѶȽ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϵѹǿ���ֲ��� | |
| B�� | ���������ɫ���ֲ��� | |
| C�� | SO3������ٷ������ֲ��� | |
| D�� | ÿ����1 mol SO3��ͬʱ����1 mol NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �ɱ��������䶳�� | |
| B�� | �Ȼ��ƿ�������ˮ�� | |
| C�� | ζ��������ʳƷ��ζ�� | |
| D�� | С�մ���һ�����ɼ���������������ͷ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3�ڷ�Ӧ�еõ����� | B�� | O2�ڷ�Ӧ��ʧȥ���� | ||
| C�� | NO�Ƿ�Ӧ�Ļ�ԭ���� | D�� | 1mol�������ڷ�Ӧ�еõ�4mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
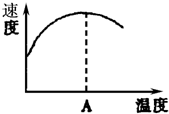 ø�ǵ����ʣ����е����ʵ����ԣ�ø�ܴ��ܶѧ��Ӧ����ͼ��ʾø�μӵķ�Ӧ�У��¶��뷴Ӧ���ʵĹ�ϵ���������߱仯ԭ�������¶ȣ�����Ӧ���ʣ��¶ȹ��ߣ�ʹ����ʧȥ���ԣ���Ӧ���ʼ�С��
ø�ǵ����ʣ����е����ʵ����ԣ�ø�ܴ��ܶѧ��Ӧ����ͼ��ʾø�μӵķ�Ӧ�У��¶��뷴Ӧ���ʵĹ�ϵ���������߱仯ԭ�������¶ȣ�����Ӧ���ʣ��¶ȹ��ߣ�ʹ����ʧȥ���ԣ���Ӧ���ʼ�С���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1��1mol��������������ȫȼ�����ɶ�����̼��Һ̬ˮ���ų�����1558.3kJ��д������ȼ�յ��Ȼ�ѧ����ʽC2H6��g��+$\frac{7}{2}$O2��g���T2CO2��g��+3H2O��l����H=-1558.3KJ/mol��
��1��1mol��������������ȫȼ�����ɶ�����̼��Һ̬ˮ���ų�����1558.3kJ��д������ȼ�յ��Ȼ�ѧ����ʽC2H6��g��+$\frac{7}{2}$O2��g���T2CO2��g��+3H2O��l����H=-1558.3KJ/mol���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com