

| A. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | |
| B. | ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | |
| C. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ | |
| D. | d点溶液中含有的溶质只有Na2SO4 |
分析 加入NaOH溶液,开始时没有沉淀生成,说明溶液中含有氢离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,沉淀部分溶解,则溶液中一定含有Al3+,根据离子共存可知,溶液中一定不存在HCO3-;
当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+;根据溶液电中性可知,溶液中还必须存在阴离子,所以一定还有SO42-;
从ab和cd耗碱体积比值可知,若为Fe3+,则Fe3+和Al3+的物质的量之比为1:1,刚好与纵坐标数据吻合;若为Mg2+,Mg2+和Al3+的物质的量之比为1.5:1,不能与纵坐标数据吻合,所以溶液中一定含有Fe3+,一定不含Mg2+.
解答 解:oa段发生反应:H++OH-=H2O,bc段发生反应:NH4++OH-=NH3•H2O,cd 发生反应Al(OH)3+OH-=AlO2-+2H2O,故可以肯定溶液中一定有的离子为:H+、NH4+、Al3+;从ab和cd耗碱体积比值可知,若为Fe3+,则Fe3+和Al3+的物质的量之比为1:1,刚好与纵坐标数据吻合;若为Mg2+,Mg2+和Al3+的物质的量之比为1.5:1,不能与纵坐标数据吻合,所以溶液中一定含有Fe3+,一定不含Mg2+,
A.根据分析可知,原溶液中含有的Fe3+和Al3+,且二者的物质的量相等,即其物质的量之比为1:1,故A正确;
B.溶液中不存在镁离子,ab段发生的反应为:Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,故B错误;
C.溶液中含有的阳离子必定有Fe3+、H+、NH4+、Al3+,一定不存在Mg2+,故C错误;
D.在d点溶液中含有的溶质并不只有Na2SO4,还含有NaAlO2,故D错误;
故选A.
点评 本题考查了常见离子的性质及检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,明确铝元素及其化合物性质为解答关键,本题中正确判断存在铁离子而不存在镁离子为易错点,需要合理分析图象曲线变化及数据.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴加浓硫酸碳化变黑 | B. | 能与硝酸反应生成纤维素三硝酸酯 | ||
| C. | 能水解生成葡萄糖 | D. | 与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烹饪食物时,加入适量食盐 | |
| B. | 在火腿制作中,加入大量亚硝酸钠作为防腐剂 | |
| C. | 在烹饪鱼类食物时,加入适量食醋 | |
| D. | 在饮料制作中,常加入适量的天然色素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
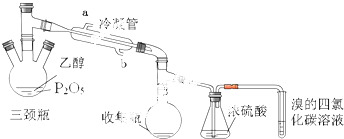
| 实验 | P2O5/g | 92%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要证明硫酸亚铁铵晶体中含有NH4+,可以取少量晶体溶于水,加入足量NaOH浓溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| B. | KClO3、KNO3、KMnO4等强氧化剂或其混合物不能研磨,否则将引起爆炸 | |
| C. | 常温下用pH试纸分别测定0.1mol•L-1NaClO溶液和0.01mol•L-1NaClO溶液的pH,可以比较浓度对水解程度的影响 | |
| D. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取Cl2:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2OH-+Cl2↑+H2↑ | |
| B. | 碘化钾溶液跟适量溴水反应:2I-+Br2=I2+2Br- | |
| C. | 将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将氯气通入氯化亚铁溶液中:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为正值 | |
| B. | 恒温恒容下,充入N2,平衡不移动 | |
| C. | 升高温度,逆反应速率增大 | |
| D. | 该反应化学方程式为CO+H2O$?_{高温}^{催化剂}$CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
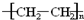 ③
③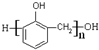 ④油脂 ⑤葡萄糖,请将相应的序号填入空格内.
④油脂 ⑤葡萄糖,请将相应的序号填入空格内. (填结构简式).
(填结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com