
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑨ | ⑥ | ⑦ | ⑧ | |||
 X溶液与Y溶液反应的离子方程式为
X溶液与Y溶液反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C均为短周期元素,它们在周期表中的位置如图所示:B、C原子最外层电子数之和等于A原子最外层电子数的2倍;B、C元素的原子序数之和是A元素的原子序数的4倍.则元素符号:A是
A、B、C均为短周期元素,它们在周期表中的位置如图所示:B、C原子最外层电子数之和等于A原子最外层电子数的2倍;B、C元素的原子序数之和是A元素的原子序数的4倍.则元素符号:A是查看答案和解析>>
科目:高中化学 来源: 题型:
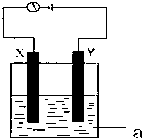 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:(CO2+3H2═CH3OH+H2O),并开发出直接以甲醇为燃料的燃料电池.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:(CO2+3H2═CH3OH+H2O),并开发出直接以甲醇为燃料的燃料电池.| nA |
| tA |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列字母分别代表一种元素.
下表是元素周期表的一部分,表中所列字母分别代表一种元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | ||||||
| 二 | B | C | D | E | |||
| 三 | F | G | H | I | K | ||
| 四 | J | L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B、若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C、Si、P、S、Cl 相应的氧化物对应水化物的酸性依次增强 |
| D、在元素周期表中,各主族元素的最高化合价与其族序数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com