
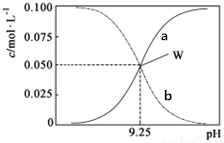
 25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | 曲线a代表c(NH3•H2O),曲线b代表(NH4+) | |
| B. | 25℃时,NH3•H2O的电离平衡常数Kb=10-4.75 | |
| C. | pH=10.5溶液中c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| D. | pH=9.5溶液中c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
分析 A.将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液,pH越大,溶液中c(NH4+)越大,根据图知,随着pH增大浓度增大的是c(NH4+)、减小的是 c(NH3•H2O);
B.W点c(NH3•H2O)=c(NH4+)=0.05mol•L-1,电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;,结合离子积常数计算;
C.已知c(NH3•H2O)+c(NH4+)=0.1mol•L-1,根据电荷守恒和物料守恒分析;
D.pH=9.5时,一水合氨浓度大于铵根离子,溶液显示碱性;
解答 解:A.将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液,pH越大,溶液中c(NH4+)越大,根据图知,随着pH增大浓度增大的是c(NH4+)、减小的是 c(NH3•H2O),故A错误;
B.W点c(NH3•H2O)=c(NH4+)=0.05mol•L-1,电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;=c(OH-)=$\frac{1{0}^{-14}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-9.25}}$=10-4.75,故B正确
C.已知:c(NH3•H2O)+c(NH4+)=0.1mol•L-1,根据电荷守恒可得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)+c(OH-)+c(NH3•H2O)=c(NH4+)+c(H+)+c(NH3•H2O)>0.1mol/L,故C错误;
D.根据图象可知,pH=9.5时,一水合氨浓度大于铵根离子,溶液显示碱性,则溶液中粒子浓度大小为:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+),故D正确;
故选BD.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确图象曲线变化及其含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断溶液中离子浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | CS2与NO2 | B. | SO2与N2O | C. | SO2与O3 | D. | PCl3与BF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
| 皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
| 碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
 的酯,若皂化值为430,求n为4.
的酯,若皂化值为430,求n为4.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 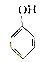 | B. | CH2═CH-Cl | ||
| C. | 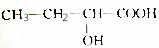 | D. | HO(CH2)4COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Al、Ga均处于ⅢA族 | B. | Ga2O3可与盐酸反应生成GaCl3 | ||
| C. | Ga(OH)3可与NaOH溶液生成NaGaO2 | D. | 酸性:Al(OH)3>Ga(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 16种 | C. | 36种 | D. | 44种 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:实验题
用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
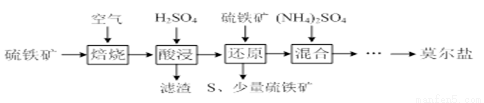
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
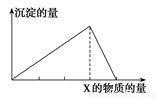
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | AlO2- | AlCl3 | NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com