
分析 氨的水溶液显弱碱性是一水合氨在水溶液中电离生成铵根离子和氢氧根离子,溶液显碱性,0.1mol/L的氨水中加入少量NH4Cl固体,溶解后铵根离子浓度增大抑制一水合氨电离氢氧根离子浓度减小,将等浓度等体积的氨水和氯化铵溶液混合,一水合氨电离程度大于铵根离子的水解程度溶液显碱性;
解答 解:氨的水溶液显弱碱性是一水合氨在水溶液中电离生成铵根离子和氢氧根离子,溶液显碱性,电离方程式为:NH3•H2O?NH4++OH-,0.1mol/L的氨水中加入少量NH4Cl固体,溶解后铵根离子浓度增大,抑制一水合氨电离氢氧根离子浓度减小,溶液PH减小,将等浓度等体积的氨水和氯化铵溶液混合,一水合氨电离程度大于铵根离子的水解程度溶液显碱性,溶液中离子浓度大小为:c (NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:NH3•H2O?NH4++OH-; 降低;c (NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查了弱电解质电离平衡和影响因素、盐类水解原理、电解质溶液中离子浓度大小比较,掌握基础是解题关键,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式:SiO2 | B. | 甲基的电子式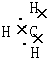 | ||
| C. | 水分子的结构式:H-O-H | D. | Na2O2中阴,阳离子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
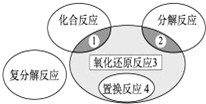
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于它的叙述中正确的是( )
,关于它的叙述中正确的是( )| A. | 1mol该有机物最多能够和2molNaOH发生反应 | |
| B. | 和乙醇发生酯化反应时,羧基中的-OH将被CH3CH2-取代 | |
| C. | 铜做催化剂并加热的条件下,羟基中的氢氧键会断裂 | |
| D. | 和  互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和硝基苯直接采用分液的方法分离 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在溴乙烷中加入NaOH水溶液共热,然后加入稀硝酸至呈酸性,再滴入AgNO3溶液,通过观察有无浅黄色沉淀来检验溴乙烷中的溴元素 | |
| D. | 在蔗糖溶液中加入稀硫酸共热,然后加入银氨溶液水浴加热,通过观察有无银镜生成来检验蔗糖的水解产物中有无还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
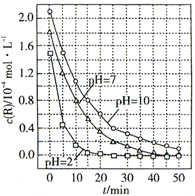
| A. | 溶液酸性越强,R的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和pH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10时R的平均降解速率为0.02 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.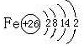 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com