
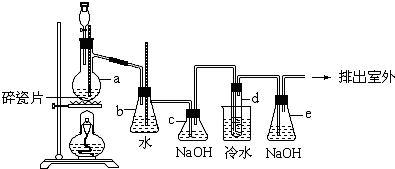
分析 实验原理:乙醇和浓硫酸反应主要生成乙烯气体,浓硫酸有强氧化性和脱水性,所以还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,e为尾气吸收装置,
(1)实验室中用乙醇和浓硫酸在170℃来制取乙烯;
(2)乙烯和溴单质的加成反应来制得1,2-二溴乙烷;
(3)根据装置图可知,当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(4)给混合液态加热时易发生爆沸现象,据此判断碎瓷片的作用;
(5)乙醇和浓硫酸混合液没有完全反应生成乙烯,以及乙烯与溴反应的利用率减少的可能原因进行解答;
(6)e为尾气吸收装置,用氢氧化钠吸收挥发的溴,防止污染.
解答 解:实验原理:乙醇和浓硫酸反应主要生成乙烯气体,浓硫酸有强氧化性和脱水性,所以还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,e为尾气吸收装置,
(1)实验室中用乙醇和浓硫酸在170℃来制取乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)乙烯和溴单质的加成反应来制得1,2-二溴乙烷,反应化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(3)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水面会上升,甚至溢出;
(4)混合液在加热过程中易发生爆沸现象,为了防止爆沸,需要加入碎瓷片,
故答案为:防止爆沸;
(5)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应;此外,也可能是实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃而生成了乙醚等,
故答案为:乙烯发生(或通过液溴)速度过快;实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃;
(6)溴有毒,不能直接排放,e装置为尾气吸收装置,用氢氧化钠溶液吸收挥发出来的溴,防止污染环境,
故答案为:吸收挥发出来的溴,防止污染环境.
点评 本题考查了制备实验方案的设,题目难度中等,注明确溴乙烷的制取原理、反应装置选择及除杂、提纯方法是解题的关键,注意掌握制备方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 和锂同一主族的都是金属元素 | B. | LiOH的碱性比NaOH的弱 | ||
| C. | 锂的化学性质不如钠活泼 | D. | Li在空气中燃烧生成Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期系中ⅠA族元素又称为碱金属元素 | |
| B. | 元素周期系中每一周期元素的种类均相等 | |
| C. | 元素周期系的形成原因是核外电子排布的周期性变化 | |
| D. | 每一周期的元素最外层电子数均是1→8,周而复始 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将石油按其成分沸点的不同加以分离 | |
| B. | 将石油按饱和与不饱和烃加以分离 | |
| C. | 得到碳原子数多的烃类 | |
| D. | 将石油中烷烃、环烷烃和芳香烃分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
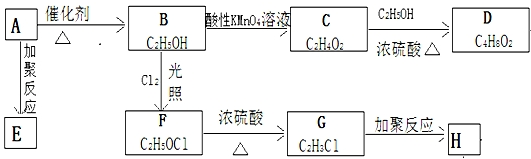
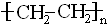 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com