
【题目】[化学——选修3:物质结构与性质] ![]()
磷酸铁锂电池对环境无污染,为绿色环保型电池,是铅酸电池的替代品,该电池的总反应为:
Li1-x FePO4+LixC6= LiFePO4+C6
(1)基态Fe2+的核外电子排布式为___________,与Fe同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),磷酸铁锂电池总反应中涉及到的C、O元素,第一电离能较大的是____________________。
(2)PO43-的空间构型是____________________。
(3)与PCl5互为等电子体的一种分子的化学式为_________。
(4)二乙烯三胺五乙酸铁-钠络合物结构如图所示,其中C原子的杂化方式为_______________。

![]()
(5)亚铁氰化钾经氯气或电解氧化,可得铁氰化钾K3Fe(CN)6],为红棕色晶体,也称赤血盐,1mol该物质含有的π键的数目为_____________。
(6)已知:LiF晶体与 NaCl晶体结构相同,F半径为0.133nm,Li+的半径为0.076nm,阴阳离子相接触,则一个晶胞中离子的空间占有率为_______ (列式并计算),分析说明该计算结果小于74.05%的原因_______。
【答案】 [Ar]3d6 K、Cr O ![]() 正四面体 AsF5或AsCl5 sp3;sp2 12NA 有LiF晶体中,正负离子直接相邻,
正四面体 AsF5或AsCl5 sp3;sp2 12NA 有LiF晶体中,正负离子直接相邻,![]() a=2(r++r-)=0.418(nm)
a=2(r++r-)=0.418(nm)
体积分数=4×(4π/3)×[(0.133)3+(0.076)3/0.4183=64.0% ![]() 阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%
阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%
【解析】(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,基态Fe2+的核外电子排布式为:[Ar]3d6;与Fe同周期的元素中,与铜原子最外层电子数相等的元素还有K、Cr;同周期第一电离能自左而右具有增大趋势,所以第一电离能较大的是O;(2)根据VSEPR理论,对于PO43-,成键原子数为BP=4,孤电子对数为VP=![]() =0,则其价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,为sp3杂化,空间构型为正四面体;(3) 等电子体是指具有相同价电子数目和原子数目的分子或离子,与PCl5互为等电子体的分子的化学式为AsF5或AsCl5;(4)在氨基乙酸铜的分子中-CH2-碳原子为sp3杂化,羰基碳原子为sp2杂化;(5)在CN-中碳原子与氮原子是以共价三键结合的,含有的2个π键。所以1 mol铁氰化钾K3Fe(CN)6]中含有的π键的数2
=0,则其价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,为sp3杂化,空间构型为正四面体;(3) 等电子体是指具有相同价电子数目和原子数目的分子或离子,与PCl5互为等电子体的分子的化学式为AsF5或AsCl5;(4)在氨基乙酸铜的分子中-CH2-碳原子为sp3杂化,羰基碳原子为sp2杂化;(5)在CN-中碳原子与氮原子是以共价三键结合的,含有的2个π键。所以1 mol铁氰化钾K3Fe(CN)6]中含有的π键的数2![]() NA;(6) 有LiF晶体中,正负离子直接相邻,a=2(r++r-)=0.418(nm),体积分数=4×(4π/3)×[(0.133)3+(0.076)3/0.4183=64.0% ;阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%。
NA;(6) 有LiF晶体中,正负离子直接相邻,a=2(r++r-)=0.418(nm),体积分数=4×(4π/3)×[(0.133)3+(0.076)3/0.4183=64.0% ;阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%。


科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如图: ,下列说法不正确的是
,下列说法不正确的是
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol咖啡酸最多能与4molH2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A的分子式为C8H12O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)A、C分子中所含官能团的名称分别为____、_______。
(2)写出A的同分异构体的结构简式:_______。
(3)写出下列反应的化学方程式和反应类型。
反应①:__________,反应类型:_____________;
反应②:___________;反应类型: _____________;
反应③:_____________,反应类型:_____________。
(4)下图为实验室制取D的装置图。

①图中试剂a名称为_______,其作用是______________。用化学方程式表示试剂a参与的化学反应:______________。
②实验结束后从混合物中分离出D的方法为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出了一种新材料,其工作原理如图所示。在外接电源作用下,材料内部发生氧化还原反应导致颜色变化,从而实现对光的透过率进行可逆性调节。已知WO3和Li4Fe4[Fe(CN6]3均为无色透明,LiWO3和Fe4[Fe(CN6]3均有颜色。下列说法正确的是( )
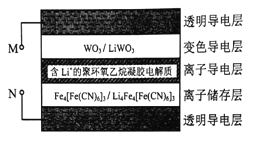
A. 当M外接电源正极时,该材料颜色变深使光的透过率降低
B. 该材料在使用较长时间后,离子导电层中Li+的量变小
C. 当M外接电源负极时,离子导电层中的Li+向变色导电层定向迁移
D. 当N外接电源正极时,离子储存层的电极反应式为:Fe4[Fe(CN6]3+4Li++4eˉ= Li4Fe4[Fe(CN6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是短周期周期表的一部分①~⑨是元素周期表的部分元素。

请回答下列问题:
(1) ③、⑤、⑥对应的原子半径最大的是_____(写元素名称)
(2)元素⑤和⑧形成的化合物的电子式是_____,该化合物溶于水被破杯的化学键类型为_______。
(3)元素⑥和⑨的最高价氧化物对应的水化物发生反应的离子方程式是________。
(4)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一稗常见的氧化剂,已知液态A与液态B充分反应生成已知液态10电子分子和一种气态单质,写出A与B反应的化学方程式:______________。
(5)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:

①溶液c的作用是____________。
②溶液b是(填化学式)_____。写出溶液b中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有CO32-、SO42-、SO32-、Fe2+、Fe3+、NH4+、Ba2+中的三种离子,实验小组为确定其化学式做了如下实验:
①准确称取6.125g样品,配制成250.00mL溶液X。
②取20.00mL溶液X,加入足量盐酸,无明显现象;再加足量BaCl2溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体0.5825g。
③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL。
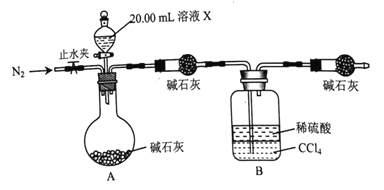
④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g。
⑤取少量溶液X,滴加0.1 mol ·L-1 KSCN溶液无明显现象,再向其中滴加0.1mol·L-1AgNO3溶液,有白色沉淀生成。
回答下列问题;
(1)完成实验①所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________________。
(2)实验③达到滴定终点的现象是________________________________________。
(3)实验④的反应结束后,打开止水夹通入N2的作用是_________________________。
(4)根据以上实验数据计算该结晶水合物的化学式为_________________________。
(5)某同学查阅资料发现 AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了如图实验装置并进行下列实验。
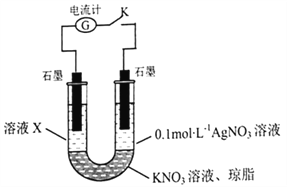
先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________(用离子方程式表示),该实验设计的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
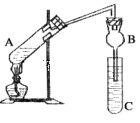
【题目】某研究性学习小组设计了如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(1)浓硫酸的作用是________________________________。
(2)球形管B除起冷凝作用外,另一重要作用是____________________________。
(3)反应中所用的乙醇是过量的,其目的是___________________。
(4)C中饱和碳酸钠溶液的作用__________________________________________。
(5)从C中分离出乙酸乙酯必须使用的一种仪器是______________________;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__________,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法不正确的是( )
A.除去Na2CO3固体中少量NaHCO3:加热
B.除去CO2中少量SO2:通过饱和NaHCO3溶液
C.除去氯气中少量氯化氢:通过氢氧化钠溶液
D.除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com