
解析:依题意可知26 g三氧化二铁是参加反应和未参加反应的三氧化二铁的质量总和。21.2 g是未反应的三氧化二铁和生成的铁的质量总和。
解法一:设反应了x g三氧化二铁,生成了y g铁。
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
x y
故160∶112=x∶y,即160y=112x ①
根据题意可列出:26-x=21.2-y ②
联解方程①② 解得:x=16,y=11.2
答:反应了的三氧化二铁的质量为16 g
解法二:设反应了三氧化二铁x g,则未反应的三氧化二铁为(26-x)g,生成的铁为[21.2-(26-x)]g=(x-4.8) g
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
x x-4.8
160∶112=x∶(x-4.8)
x=16?
答:反应的三氧化二铁为16 g。
解法三:差量法
根据反应Fe2O3+3CO![]() 2Fe+3CO2,可知在反应中固体减少的质量就是氧的质量,反应中减少氧的质量为:(26-21.2) g=4.8 g,氧原子的物质的量为:4.8 g÷16 g·mol-1=0.3 mol。
2Fe+3CO2,可知在反应中固体减少的质量就是氧的质量,反应中减少氧的质量为:(26-21.2) g=4.8 g,氧原子的物质的量为:4.8 g÷16 g·mol-1=0.3 mol。
因为1 mol Fe2O3中含3 mol氧原子,现有0.3 mol氧原子,Fe2O3的物质的量肯定是0.1 mol,质量为16 g。
答:反应的三氧化二铁为16 g。
答案:16 g


科目:高中化学 来源:读想用 高二化学(上) 题型:038
在高温条件下用一氧化碳还原26 g三氧化二铁.反应一段时间后,称得剩余物的质量为21.2 g.问反应了多少克三氧化二铁(假设反应了的三氧化二铁全部转化生成了铁)?
查看答案和解析>>
科目:高中化学 来源: 题型:
在高温条件下用一氧化碳还原26 g三氧化二铁。反应一段时间后,称量剩余物的质量为21.2 g。问反应了多少克三氧化二铁(假设反应的三氧化二铁全部转化生成铁)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省安庆市六校高三第三次联考理综化学试卷(解析版) 题型:填空题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
元素代号 | 相关信息 |
X | 它的一种核素的原子核内没有中子 |
Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
Z | 基态原子的最外层电子排布式为nsnnpn+1 |
W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq)??? ΔH=+45.6 KJ/mol
YZ- (aq)+X3W+(aq)??? ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1)??? ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
|
元素代号 |
相关信息 |
|
X |
它的一种核素的原子核内没有中子 |
|
Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
|
Z |
基态原子的最外层电子排布式为nsnnpn+1 |
|
W |
与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
|
T |
主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:
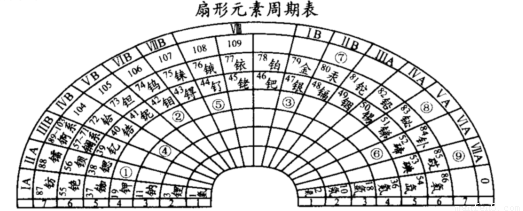
T元素在扇形元素周期表中的位置是 (填表中带圆圈的数字);上表中⑨号位置 的元素基态原子未成对电子数为 ;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是 (填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为 ,在这五种元素中电负性最大的是 。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且 与Z3-具有相同质子数和电子数,则这种离子的结构式为 。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式: 。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com