
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 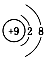 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程 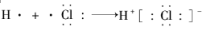 |
分析 A、具有一定数目的中子和质子的原子称为一种核素;
B、氟离子是由氟原子得一个电子形成的;
C、次氯酸中O原子分别与H原子和Cl原子形成共价键;
D、HCl是共价化合物.
解答 解:A、具有一定数目的中子和质子的原子称为一种核素,故H、D、T是三种不同的核素,故A错误;
B、氟离子是由氟原子得一个电子形成的,故氟离子的核外有10个电子,核内有9个质子,故结构示意图为 ,故B正确;
,故B正确;
C、次氯酸中O原子分别与H原子和Cl原子形成共价键,故分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ,故C错误;
,故C错误;
D、HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为: ,故D错误.
,故D错误.
故选B.
点评 本题考查电子式书写等常见的化学用语,难度不大,应注意先判断化学式中原子间的化学键类型,再用电子式写出其电子式或形成过程.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的O2和O3含有相同的质子数 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 分子晶体中一定存在分子间作用力,但可能没有共价键 | |
| D. | 将标准状况下22.4 L 氨气溶于1 L水配成溶液,可得1 mol•L-1的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SiF4和SO32-的中心原子均为sp2杂化 | |
| D. | SF6中有6对相同的成键电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
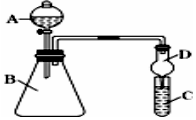 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
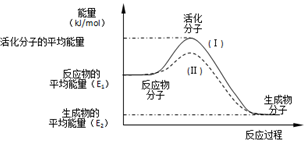 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
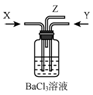 浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 洗气瓶中产生的沉淀是亚硫酸钡 | ||
| C. | 洗气瓶中有氧化还原反应发生 | D. | 在Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的液态单质可在医疗上用于冷冻麻醉 | |
| B. | Y、M两元素气态氢化物的稳定性:Y<M | |
| C. | 工业上制备Z的单质可电解其熔融态的氧化物 | |
| D. | 氧化物XO2与MO2均具有漂白性,且漂白原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com