
| A | B | C | D |
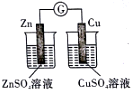 | 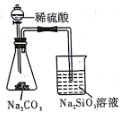 | 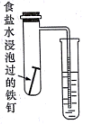 | 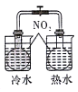 |
| 完成化学能转化为电能 | 证明非金属性强弱 S>C>Si | 验证铁发生析氢腐蚀 | 验证温度对平衡移动的影响 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该装置没有形成闭合回路;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
C.强酸性条件下铁发生析氢腐蚀,弱酸性或中性条件下铁发生吸氧腐蚀;
D.2NO2(g)?N2O4(g)△H<0,该反应的正反应是放热反应,升高温度平衡逆向移动,降低温度平衡正向移动.
解答 解:A.该装置没有形成闭合回路,所以不能产生电流,则无法实现实验目的,故A错误;
B.稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成硅酸沉淀,所以酸性:硫酸>碳酸>硅酸,则非金属性S>C>Si,故B正确;
C.食盐水为中性溶液,铁钉发生吸氧腐蚀,故C错误;
D.2NO2(g)?N2O4(g)△H<0,该反应的正反应是放热反应,升高温度平衡逆向移动气体颜色加深,降低温度平衡正向移动,气体颜色变浅,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理、物质性质是解本题关键,侧重考查学生观察、分析判断及实验操作能力,注意:如果B中硫酸换为硝酸则无法验证非金属性N>C>Si,因为硝酸具有挥发性导致影响碳酸酸性强弱检验,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种溶液中pH最小的是① | |
| B. | 3种溶液中水的电离程度最大的是② | |
| C. | ①与②等体积混合后溶液显酸性 | |
| D. | ①与③等体积混合后c(H+)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeC13溶液中滴加HI解液:2Fe3++2HI═2Fe2++2H++I2 | |
| B. | 1mol•L-1NaA1O2溶液和4 mol•L-1HCl溶液等体积混合:AlO2++4H+═Al3++2H2O | |
| C. | NH4HSO4溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O | |
| D. | Na2S2O3溶液中滴加过量稀H2SO4:3S2O32-+2H+═4S↓+2SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰化钾中含有离子键和极性键 | |
| B. | 氰化钾中碳元素的化合价为+4价 | |
| C. | KCN与KMnO4溶液反应可能生成CO2和N2 | |
| D. | 相同条件下,KCN溶液的碱性强于CH3COOK溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
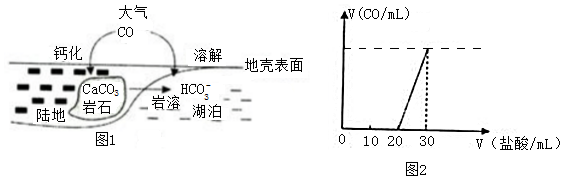
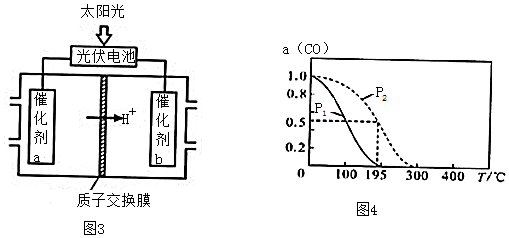
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉加入硝酸中 | B. | 溴化亚铁溶液中通氯气 | ||
| C. | AlCl3溶液中滴入NaOH 溶液 | D. | 铁粉在硫蒸气中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com