
分析 (1)依据氢气在氯气中燃烧现象解答;
(2)漂白粉的有效成分次氯酸钙;
(3)检验硫酸根离子,应排除银离子、碳酸根离子、亚硫酸根离子的干扰;
(4)实验室制备氯气原理为二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气和水,依据方程式中元素化合价变化判断氧化剂和还原剂及其物质的量之比;
(5)蓝帆为五水硫酸铜,溶于水得到硫酸铜溶液,加入氢氧化钡反应生成氢氧化铜沉淀和硫酸钡沉淀.
解答 解:(1)纯净的氢气在氯气中安静的燃烧,发出苍白色火焰;
故答案为:苍白色;
(2)漂白粉的有效成分次氯酸钙;
故答案为:次氯酸钙;
(3)检验硫酸根离子,应排除银离子、碳酸根离子、亚硫酸根离子的干扰,方法为:先加入 过量盐酸排除银离子、碳酸根离子、亚硫酸根离子的干扰,然后再加入 氯化钡溶液,现象是:刚开始没有明显现象,加盐酸后白色沉淀生成,说明该溶液中含有SO42-;
故答案为:过量盐酸;氯化钡溶液;刚开始没有明显现象,加盐酸后白色沉淀生成;
(4)实验室制备氯气原理为二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中锰元素化合价降低,二氧化锰做氧化剂,氯化氢中一半的氯离子化合价升高为氯气中0价,氯化氢做还原剂,氧化剂与还原剂物质的量之比为:1:2;
故答案为;MnO2; HCl; 1:2;
(5)蓝帆为五水硫酸铜,化学式为:CuSO4•5H2O,溶于水得到硫酸铜溶液,加入氢氧化钡反应生成氢氧化铜沉淀和硫酸钡沉淀,离子方程式:Cu2++SO42-+Ba2++2OH-=Cu (OH)2↓+BaSO4↓;
故答案为;CuSO4•5H2O; Cu2++SO42-+Ba2++2OH-=Cu (OH)2↓+BaSO4↓;
点评 本题为综合题,考查了氯气、漂白粉、蓝帆的性质,氯气的实验室制备方法,硫酸根离子的检验,侧重考查学生分析问题、解决问题能力,掌握基础是解题关键,题目难度不大.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 使新鲜的红玫瑰花褪色(HCl) | B. | 新制氯水呈浅黄绿色(Cl2) | ||
| C. | 加入小苏打固体,有气泡产生(H+) | D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
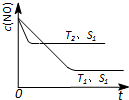 (1)已知在常温常压下:
(1)已知在常温常压下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
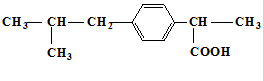 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +8 | C. | +7 | D. | +5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com