
【题目】目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
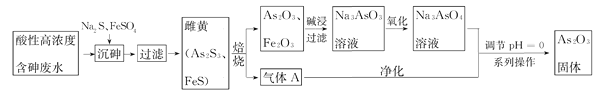
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
【答案】+3 与过量的S2-结合生成FeS沉淀,防止As2S3与S2-结合生成AsS33-(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) SO2 品红溶液 酸性越强,物质的氧化性或者还原性可能增强或增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率 过滤 洗涤 干燥 As2O3+2H2O2+H2O=2H3AsO4
【解析】
酸性高浓度含砷废水加入硫化钠、硫酸亚铁,发生反应产生As2S3和FeS,其中硫酸亚铁可除去过量的硫离子,过滤得到滤渣中含有As2S3和FeS,焙烧滤渣,可生成As2O3、Fe2O3,向其中加入NaOH溶液生成Na3AsO3,Na3AsO3被氧化生成Na3AsO4,生成的气体为SO2,SO2与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,以此解答该题。
(1)由于在任何化合物中,所有元素化合价代数和等于0,在H3AsO3中,H为+1价,O为-2价,所以As元素化合价为+3价;
(2)“沉砷”中FeSO4的作用是与过量的S2-结合生成FeS沉淀,防止As2S3与S2-结合生成AsS33-,以提高沉砷效果;
(3)滤渣中含有As2S3和FeS,焙烧滤渣,As、Fe转化为As2O3、Fe2O3,S元素转化为SO2气体,所以“焙烧”过程产生的气体A的化学式为SO2,SO2气体具有漂白性,可使品红溶液褪色,所以检验该气体常用试剂为品红溶液。
(4)调节pH=0时,由Na3AsO4与净化的SO2气体反应制备As2O3的离子方程式为2AsO43-+2SO2+2H+![]() As2O3+2SO42-+H2O,由于溶液酸性越强,溶液中c(H+)越大,化学平衡正向移动,有利于提高As2O3的产率,且溶液酸性越强,微粒的还原性、氧化性也会越强,使反应更容易进行;从反应体系中获得As2O3固体,系列操作包括过滤、洗涤、干燥。
As2O3+2SO42-+H2O,由于溶液酸性越强,溶液中c(H+)越大,化学平衡正向移动,有利于提高As2O3的产率,且溶液酸性越强,微粒的还原性、氧化性也会越强,使反应更容易进行;从反应体系中获得As2O3固体,系列操作包括过滤、洗涤、干燥。
(5)As2O3可以与H2O2反应H3AsO4,根据电子守恒、原子守恒,可得反应的方程式为:As2O3+2H2O2+H2O=2H3AsO4。


科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产中有广泛的用途
Ⅰ![]() 实验室可用如下装置
实验室可用如下装置![]() 略去部分夹持仪器
略去部分夹持仪器![]() 制备亚硝酸钠。
制备亚硝酸钠。
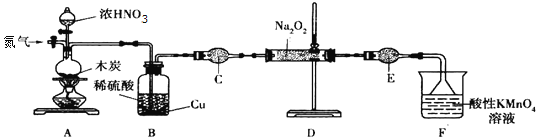
已知:①![]() ;
;
②酸性条件下,NO和![]() 都能与
都能与![]() 反应生成
反应生成![]() 和
和![]() ;
;![]() 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间![]() ,目的是_______________________。
,目的是_______________________。
(2)装置A中发生反应的化学方程式为_______。酸性![]() 溶液的作用是_______。
溶液的作用是_______。
(3)仪器C的名称为______________,其中盛放的药品为 ____________![]() 填名称
填名称![]() 。
。
Ⅱ![]() 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
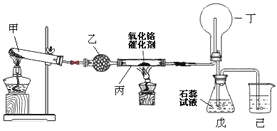
(1)已知甲装置试管中的固体是碳酸铵![]() 晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
(2)写出受热时丙装置发生反应的化学方程式为________________。
(3)当戊中观察到____________________________现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因:______________________。如何改进装置?_______。
(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.Na2CO3溶液显碱性:![]() +2H2O
+2H2O![]() H2CO3+2OH
H2CO3+2OH
B.HS电离的离子方程式:HS+H2O![]() H3O++S2
H3O++S2
C.少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++![]() +2OH
+2OH![]() CaCO3↓+2H2O+
CaCO3↓+2H2O+![]()
D.在0.5 mol·L1的K2Cr2O7溶液中存在如下平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+,其平衡常数的表达式为
+2H+,其平衡常数的表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是一种利用微生物将废水中的尿素(CO(NH2)2)转化为环境友好物质的原电池装置示意图甲,利用该电池在图乙装置中的铁上镀铜。下列说法正确的是( )
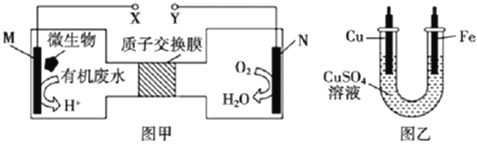
A.图乙中Fe电极应与图甲中Y相连接
B.图甲中H+透过质子交换膜由右向左移动
C.图甲中M电极反应式:CO(NH2)2 +5H2O -14e = CO2+2NO2+14H+
D.当图甲中N电极消耗0.5 mol O2时,图乙中阴极增重64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Ag+ + Cu = Cu2+ + 2Ag,设计如图所示原电池,下列说法错误的是( )。
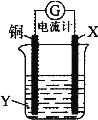
A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为Ag+ + e-= Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为1L的密闭容器中,l molX和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
A.c(X)∶c(Y)∶c(Z) = 2∶1∶lB.容器内原子总数不再发生变化
C.X的百分含量不再发生变化D.同一时间内消耗2n mol X的同时生成n mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中选择合适的完成下列各题。
①稀硝酸;②CO;③HF;④熔融NaHSO4;⑤CaO;⑥Cu;⑦蔗糖;⑧Fe2(SO4) 3;⑨酒精;⑩硫酸钡;醋酸;三氧化硫;氯气;醋酸钠
(1) 属于强电解质的是____________________(填序号,下同) 。
(2) 属于弱电解质的是____________________。
(3) 属于非电解质的是_____________________。
(4) 写出③、两种物质在水溶液中的电离方程式:③___________________________;_________________________________。
(5) 醋酸钠溶液显_________性(填酸或碱)的原因:______________________________________________________________ (用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A. 25℃时,Ksp(CaCO3)=2.8×10-9
B. 加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C. 滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. 滤液M中: 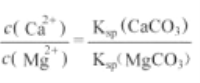
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是( )
SnI4制备SnI4。下列说法错误的是( )
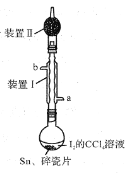
A. 加入碎瓷片的目的是防止暴沸
B. SnI4可溶于CCl4中
C. 装置Ⅰ中a为冷凝水进水口
D. 装置Ⅱ的主要作用是吸收挥发的I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com