
【题目】Na2CO3、MaHCO3及xNa2CO3·yH2O(过碳酸的)在工农业生产上用途非常广泛。
(1)0.1mol/LNa2CO3溶液加水稀释时,溶液的pH____ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为K= ________ 。(填数值)
H2CO3+OH-的平衡常数为K= ________ 。(填数值)
②反应HCO3-+NH3·H2O![]() CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO32-时,终点溶液颜色变化是______。
②滴定H2O2时,MnO4-被还原为Mn2+,反应的离子方程式为_______。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。y/x的值(列出计算过程)__________。
【答案】 减小 2×10-8 0.09 由黄色变成橙色 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O n(CO32-)=1/2n(HCl)=1/2×0.1000mol/L×25mL×10-3L/mL=1.25×10-3mol,n(H2O2)=5/2n(KMnO4)=5/2×0.0400mol/L×19mL×10-3L/mL=1.9×10-3mol,y/x=n(H2O2)/n(CO32-)=1.9×10-3mol/(1.25×10-3mol)=1.52
【解析】(1)0.1molL-1Na2CO3溶液加水稀释时,促进碳酸钠水解,溶液中氢氧根离子浓度减小,溶液的pH减小,故答案为:减小;
(2)①NaHCO3水解反应HCO3-+H2OH2CO3+OH-的平衡常数为K=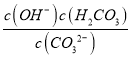 =
=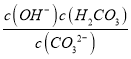 ×
×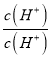 =
=![]() =
=![]() =2×10-8,故答案为:2×10-8;
=2×10-8,故答案为:2×10-8;
②反应HCO3-+NH3H2OCO32-+NH4++H2O的平衡常数为K=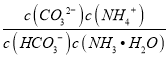 =
=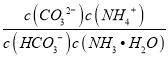 ×
×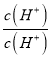 ×
×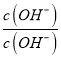 =
=![]() =
=![]() =0.09,故答案为:0.09;
=0.09,故答案为:0.09;
(3)①称取1,5000g过碳酸钠配制100ml溶液A,分别取A溶液10.00ml,一份加入甲基橙用0.1000mol/L盐酸滴定终点,溶液黄色变化为橙色,故答案为:由黄色变成橙色;
②另一份加入100ml6%的硫酸,用0.0400mol/L高锰酸钾溶液滴定终点,发生氧化还原反应,酸溶液中高锰酸钾溶液氧化过氧化氢生成氧气,反应的离子方程式为:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O,故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
③n(CO32-)=![]() n(HCl)=
n(HCl)= ![]() ×0.1000mol/L×25ml×10-3L/ml=1.25×10-3mol,n(H2O2)=
×0.1000mol/L×25ml×10-3L/ml=1.25×10-3mol,n(H2O2)= ![]() n(KMnO4)=
n(KMnO4)= ![]() ×0.0400mol/L×19ml×10-3L/mol=1.9×10-3mol,
×0.0400mol/L×19ml×10-3L/mol=1.9×10-3mol, ![]() =
=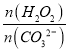 =
=![]() =1.52,故答案为:1.52。
=1.52,故答案为:1.52。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示进行实验,下列说法不正确的是( ) 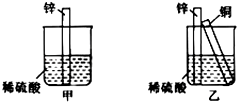
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn﹣2e﹣═Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4 (草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液。
(1)在水溶液中H2C2O4的电离方程式为________。
(2)用0.1molL-1NaOH溶液滴定0.1molL-1草酸溶液的滴定曲线如下图所示。
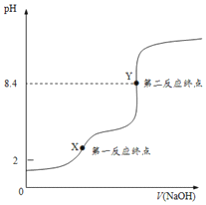
①滴定过程中从X点到Y点,反应的离子方程式为________。
②用NaOH溶液滴定至过量,整个过程锥形瓶里溶液中水的电离程度 _______(填序号)。
a.始终减小 b.始终增大 c.先减小后增大 d.先增大后减小
③X点时,c(Na+)-c(C2O42-)_____c(H2C2O4) +c(HC2O4-) (选填:>、<或=);Y点时,c(OH-) - c(H+) _______c(H2C2O4)+ c(HC2O4-) (选填:>、<或=)。
(3)某同学用邻苯二甲酸氢钾(![]() ,摩尔质量为204gmol-1,易溶于水的固体,水溶液呈弱酸性)标定NaOH溶液,主要实验步骤如下:
,摩尔质量为204gmol-1,易溶于水的固体,水溶液呈弱酸性)标定NaOH溶液,主要实验步骤如下:
步骤Ⅰ.准确称取0.4896g邻苯二甲酸氢钾于锥形瓶中,用少量温水溶解
Ⅱ.加入1~2滴酚酞作指示剂
Ⅲ.用待定NaOH溶液滴定到终
①判断达到滴定终点的方法是___________。
②若滴定到终点消耗NaOH溶液为25.00mL,则该次滴定测得的NaOH溶液浓度为 _______。
③下列情况会导致测得的NaOH溶液浓度偏大的是__________(填序号)。
a.滴定管未用待定NaOH溶液润洗
b.滴定前滴定管尖端部分有气泡,滴定过程中消失
c.滴定后期用少量蒸馏水稀释锥形瓶中溶液
d.读数时,滴定前仰视滴定管刻度,滴定后平视滴定管刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH ![]() 、Fe3+、CO
、Fe3+、CO ![]() 、SO
、SO ![]() 、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( ) 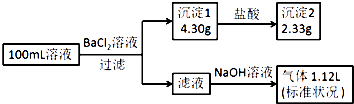
A.原溶液一定存在CO ![]() 和SO
和SO ![]() ,一定不存在Fe3+
,一定不存在Fe3+
B.原溶液一定存在Cl﹣ , 可能存在Na+
C.原溶液中c(Cl﹣)≥0.1mol?L﹣1
D.若原溶液中不存在Na+ , 则c(Cl﹣)<0.1mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.分子数为NA的CO和C2H4混合气体的体积约为22.4 L
B.标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
C.用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA
D.0.1 L 3.0 mol?L﹣1的NH4NO3溶液中含有NH ![]() 的数目为0.3NA
的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是
A.16 g B.32 g C.64 g /mol D.32 g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
A. 氧气 B. 二氧化氮 C. 二氧化氮和氧气 D. 二氧化氮和一氧化氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com