
【题目】下列共价化合物中,共价键的键能最大的是( )
A.HCl B.HF C.HBr D.HI
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题。
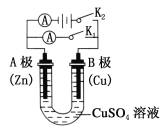
(1)①打开K2,合并K1。A电极可观察到的现象是_____________;B极的电极反应式为________________。
②打开K1,合并K2。A电极可观察到的现象是____________;B极的电极反应为________________________。
(2)判断原电池的正负极时,不仅要看金属活泼性顺序,还要注意此金属在电解质溶液中的活泼性。试回答下列问题:将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,负极是 ,若插入氢氧化钠溶液中形成原电池,负极是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
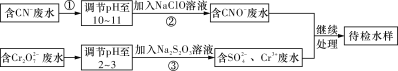
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:________________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移____________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_____________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为
A. 13:8:27 B. 13:9:27
C. 26:16:27 D. 286:8:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)某有机物的结构简式为HOOC—CH=CH-CH2OH。
回答下列问题:
(1)请你写出该有机物所含有的官能团的名称: 。
(2)验证该有机物中含有-COOH官能团常采用的方法和现象: 。
(3)写出该有机物与溴水反应的化学方程式: ,反应类型为 。
(4)该有机物可与乙醇发生酯化反应,写出该反应的方程式: ,请你写出能增大该反应反应速率的一条措施: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的元素中,一定属于主族元素的有
A. 元素的原子最外层电子个数为2
B. 元素的原子最外层电子个数为6
C. 位于元素周期表中ⅡA族右边的元素
D. 阴离子RO4﹣中R元素
查看答案和解析>>
科目:高中化学 来源: 题型:
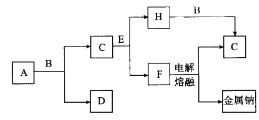
【题目】中学化学中常见的几种物质存在如图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C(图中部分产物和反应条件已略去)。
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式:_________。
(2)将ag粉未A加入bmol/L的B的浓溶液cL中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,NA可表示为_____________。
(3)将B的浓溶液与H的浓溶液混合,立即产生大最气体C,该反应的离子方程式为_______。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
实验过程中观察到如下现象: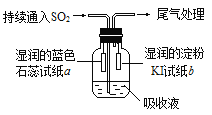
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是_______(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因:_____________
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国地质学家发现了一种新矿物,这种新矿物由X、Y、Z、W、R、T六种主族元素组成,其中X、Y、Z是金属元素,W、R、T是非金属元素。新矿物的化学式可表示为X3Y2(ZWR4)3T2;已知X和Z同主族,Y、Z、R、T同周期,T是非金属性最强的元素;Z原子的最外层电子数与次外层电子数相等,另外与R同主族的另一短周期表元素是Q,Q元素的最高氧化物对应水化物甲在工业上用途广泛,用途如下图,X与R的原子序数之和是W的2倍。
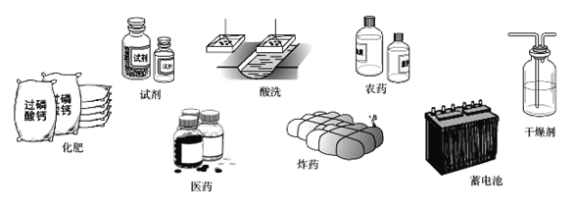
请回答下列问题
(1)W在元素周期表中的位置是 。
(2)Y、Z、R、T四种同周期元素中原子半径最大的是 (用元素符号表示,后同)。
(3)写出这种新矿物的化学式: 。
(4)写出由甲与XT2反应制T的氢化物的化学方程式 。
(5)在长途运输活鱼时,常在水中加入一定量的XR2,加入XR2的目的是杀菌消毒和 。
(6)由短周期元素组成的某些粒子,如SO2、O3、NO可互称为等电子体,则与Z同周期元素组成的粒子中,能与N3-、CS2互称为等电子体的粒子是一氧化二氮、二氟化铍和 (填符合要求粒子的名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com