
【题目】分析下列有机物的结构简式,完成填空。
①CH3CH2CH2CH2CH3 ② ![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥C2H5OH ⑦
⑥C2H5OH ⑦![]() ⑧
⑧![]() ⑨CH3CH2COOCH3
⑨CH3CH2COOCH3
(1)属于烷烃的是________(填写序号,下同);属于烯烃的是________;属于芳香烃的是______;属于酚的_____;属于醛的是_______;属于酯的是_______。
(2)互为同分异构体的是______与______; ______与_______。
【答案】① ③ ② ④ ⑦ ⑨ ② ③ ⑧ ⑨
【解析】
根据各有机物所含官能团及结构特点分析作答。
①CH3CH2CH2CH2CH3中碳原子间以单键形成链状,碳原子剩余价键均与氢原子结合,分子式为C5H12,故属于烷烃;
②![]() 含有苯环,组成元素只有C、H,分子式为C9H12,故属于芳香烃;
含有苯环,组成元素只有C、H,分子式为C9H12,故属于芳香烃;
③![]() 组成元素只有C、H,含官能团碳碳双键,分子式为C9H12,故属于烯烃;
组成元素只有C、H,含官能团碳碳双键,分子式为C9H12,故属于烯烃;
④![]() 的官能团羟基与苯环直接相连,分子式为C7H8O,故属于酚类;
的官能团羟基与苯环直接相连,分子式为C7H8O,故属于酚类;
⑤![]() 的官能团羟基与苯环侧链碳相连,分子式为C8H10O,故属于芳香醇类;
的官能团羟基与苯环侧链碳相连,分子式为C8H10O,故属于芳香醇类;
⑥C2H5OH的官能团羟基与链烃基相连,分子式为C2H6O,故属于醇类;
⑦![]() 的官能团为醛基,分子式为C7H6O,故属于醛类;
的官能团为醛基,分子式为C7H6O,故属于醛类;
⑧![]() 的官能团为羧基,分子式为C4H8O2,故属于羧酸类;
的官能团为羧基,分子式为C4H8O2,故属于羧酸类;
⑨CH3CH2COOCH3的官能团为酯基,分子式为C4H8O2,故属于酯类;
(1)属于烷烃的是①;属于烯烃的是③;属于芳香烃的是②;属于酚的④;属于醛的是⑦;属于酯的是⑨。
(2)②和③的分子式均为C9H12,其结构不同,互为同分异构体;⑧和⑨的分子式均为C4H8O2,其结构不同,互为同分异构体。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________________。

(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________。

(7)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:

(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中导管没有伸入到液面下,原因是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
A | 2p能级电子半充满 |
B | 与A同周期,且原子核外有2个未成对电子 |
C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
D | 其基态原子外围电子排布为msnmpn+2 |
E | 前四周期元素中,E元素基态原子未成对电子数最多 |
F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有__种能量不同的电子,电子排布式为__,画出F元素基态原子的价电子排布图___。
(2)与B相邻的同周期元素的第一电离能由大到小的顺序为___。(用元素符号表示)
(3)B、C、D三种元素的简单离子的半径由小到大的顺序为___(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合后的溶液呈中性B.混合前两溶液中水的电离程度不同
C.氢氧化钠和醋酸的浓度不相等D.混合前的醋酸约1%发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是
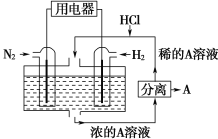
A. 通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+
B. 反应过程中溶液的pH会变大,故需要加入盐酸
C. 该电池外电路电流从通入H2的电极流向通入N2的电极
D. 通入H2的电极为负极,A为NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com