
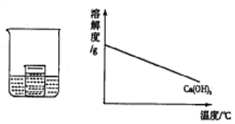
 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )| 序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
| A | 水 | 硝酸铵 | 产生白色沉淀 |
| B | 水 | 浓硫酸 | 无明显变化 |
| C | 盐酸 | 镁条 | 产生白色沉淀 |
| D | 硫酸 | 氢氧化钠 | 无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
分析 如图所示,解答此题首先要明确氢氧化钙的溶解度随温度的变化情况:随温度的升高其溶解度变小;其次要了解试剂X和试剂Y混合后烧杯内温度的变化情况.
解答 解:A、硝酸铵溶于水吸收热量,烧杯内物质温度降低,氢氧化钙的溶解度升高,不会产生白色沉淀,故A错误;
B、浓硫酸溶于水放热,温度升高,氢氧化钙的溶解度降低,会产生白色沉淀,故B错误;
C、镁条和稀盐酸反应时放出热量,温度升高,氢氧化钙溶解度降低,会产生白色沉淀,故C正确;
D、氢氧化钠和硫酸反应放热,温度升高,会产生白色沉淀,故D错误.
故选C
点评 本题考查了物质溶解度的分析判断,了解氢氧化钙的溶解度随温度变化情况和各物质溶于水或反应时伴随的能量变化是解答此类题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 30℃甲苯与浓硫酸浓硝酸混合,反应的主要产物为邻硝基甲苯和对硝基甲苯 | |
| C. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | 冰醋酸 | C. | HCl | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
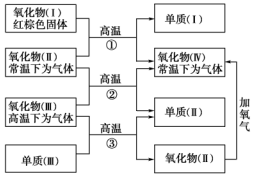 以下一些氧化物和单质之间可发生如图所示的反应:
以下一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com