
可逆反应mA(s)+nB(g)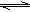 pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )
pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )
A.m+n<p
B.n>p
C.X点时v(正)>v(逆)
D.X点比Y点的正反应速率快
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl﹣的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
(1)写出该反应的离子方程式 .
(2)反应开始时反应速率加快的原因是 .
(3)反应后期反应速率减慢的原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是( )
A. 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液
B. 乙醇(水):加入新制生石灰,蒸馏
C. 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液
D. 乙酸(乙醇):加入金属钠,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)===2C(g)+2D(g),在不同情况下测得的反应速率如下,其中反应速率最大的是( )
A.v(D)=0.4 mol·L-1·s-1 B.v(C)=0.5 mol·L-1·s-1
C.v(B)=0.6 mol·L-1·s-1 D.v(A)=0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S+SO2。请问下列说法错误的是( )
A、电池的负极材料为Li B、负极发生的电极反应为Li – e- = Li+;
C、电池正极发生的电极反应为2SOCl2+4e- = 4Cl-+S+SO2;
D、组装该电池可在水溶液的条件下进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是( )
A.元素X:它的原子中M层比L层少2个电子
B.元素Y:它的二价阳离子核外电子总数与氩原子相同
C.元素Z:位于元素周期表中的第三周期第ⅢA族
D.元素W:它的焰色反应颜色呈浅紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中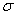 键与
键与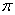 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
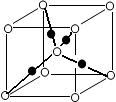
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com