
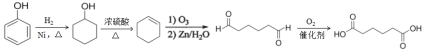
【题目】EPR橡胶(聚乙丙烯)和工程材料聚碳酸酯(简称PC)的一种合成路线如下:

已知:酯与含羟基的化合物可发生如下酯交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
请回答:
(1)D中所含的官能团是_______。
(2)EPR橡胶的结构简式_______。
(3)下列说法正确的是_______(填字母)。
a.反应③的原子利用率为100%
b.反应④为取代反应
c.1mol F与足量金属Na反应,最多可生成22.4L H2(标准状况下)
(4)反应②的化学方程式是_______。
(5)反应②生成E时会产生多种副产物,其中有一种分子式为C9H12O2的副产物M,其结构简式为_______。
(6)反应⑤的化学方程式是_______。
(7)已知: (R1、R2、R3代表烃基)写出以D为原料合成己二酸[HOOC(CH2)4COOH]的合成路线,无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
(R1、R2、R3代表烃基)写出以D为原料合成己二酸[HOOC(CH2)4COOH]的合成路线,无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2
【答案】羟基 或 —OH ![]() a c
a c 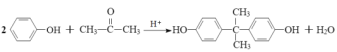
![]()
![]()
【解析】
EPR橡胶(聚乙丙烯)是由单体乙烯与丙烯聚合而成,A与苯在催化剂作用下形成C,根据C的分子式C9H12及原子守恒可知,A为丙烯,B为乙烯;则C为苯丙烯,在酸性条件下和氧气反应生成物质D,其分子式为C6H6O则为苯酚,2 mol苯酚与1 mol丙酮在酸性条件下反应生成E(![]() ),再结合提示信息推出最后E物质与
),再结合提示信息推出最后E物质与![]() 连续发生酯交换生成聚碳酸酯(PC);因B为乙烯,在银作催化剂作用下发生氧化反应生成环氧乙烷(
连续发生酯交换生成聚碳酸酯(PC);因B为乙烯,在银作催化剂作用下发生氧化反应生成环氧乙烷(![]() ),再经过反应④得到
),再经过反应④得到![]() ,根据提示信息可知,1 mol该酯与2mol甲醇发生两次酯交换反应生成
,根据提示信息可知,1 mol该酯与2mol甲醇发生两次酯交换反应生成![]() 和乙二醇(HOCH2CH2OH),故F为HOCH2CH2OH,据此分析作答。
和乙二醇(HOCH2CH2OH),故F为HOCH2CH2OH,据此分析作答。
根据上述分析可知,
(1)D为苯酚,其官能团为羟基 或 —OH,
故答案为:羟基 或 —OH;
(2)EPR橡胶为聚乙丙烯,是乙烯与丙烯通过加聚反应得到的聚合物,根据单体可推出其结构简式为:![]() ,
,
故答案为:![]() ;
;
(3)a. 反应③为乙烯加氧氧化为环氧乙烷的过程,其化学方程式为:2CH2=CH2 + O2![]() 2
2![]() ,则该反应的原子利用率为100%,故a项正确;
,则该反应的原子利用率为100%,故a项正确;
b. 反应④为碳原子的不饱和度增大,不属于取代反应,故b项错误;
c. 1个F分子中含2个羟基,根据醇与Na反应的转化关系-OH![]() H2可知,1mol F与足量金属Na反应,最多可生成1 mol
H2可知,1mol F与足量金属Na反应,最多可生成1 mol![]() 22.4L/mol = 22.4 L H2(标准状况下),故c项正确,
22.4L/mol = 22.4 L H2(标准状况下),故c项正确,
答案选ac;
(4)由上述分析可知,反应②的化学方程式为 ,
,
故答案为: ;
;
(5)分子式为C9H12O2,则应是丙酮与苯酚按物质的量为1:1反应的产物,其结构简式为:![]() ,
,
故答案为:![]() ;
;
(6)E物质与![]() 发生酯交换,最终生成聚碳酸酯(PC),其反应方程式可表示为:
发生酯交换,最终生成聚碳酸酯(PC),其反应方程式可表示为:![]() ,
,
故答案为: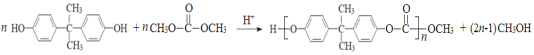 ;
;
(7)采用逆合成分析法,根据HOOC(CH2)4COOH中的羧基,可以考虑用己二醛氧化制备,根据给定信息,若要制备己二醛,可采用环己烯臭氧氧化的方法,再结合D(苯酚)可与氢气加成为环己醇,最后考虑醇的消去反应制备环己烯,则其完整的合成路线可表示为: ,
,
故答案为: 。
。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标况下2.24L的苯完全燃烧生成CO2的分子数目为0.6NA
B.7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.3NA个
C.18g的D2O含有的中子数目均为10NA
D.42g的C2H4与C3H6的混合物中含有的共价键数目为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是( )

A.装置C中氧化剂和还原剂的物质的量之比为2:3
B.装置B中加入的物质可以是碱石灰或无水氯化钙
C.装置D中液体可以使干燥的红色石蕊试纸变蓝
D.装置A中加入的固体,可以是NH4HCO3或NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示。
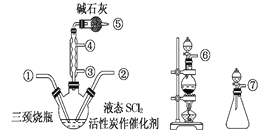
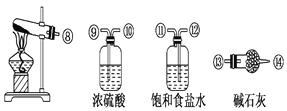
(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是⑥→___→①;___→②(已知①处通入Cl2、除杂装置可以重复使用)。
(2)冷凝管上连接的干燥管的作用是:①尾气处理;②___。
(3)实验室制Cl2的离子方程式为___。
(4)该实验中制取SO2,下列最适宜的试剂是___(填下列字母编号)。
A.Cu固体与18.4molL-1硫酸
B.Na2SO3固体与20%硫酸
C.Na2SO3固体与70%硫酸
D.Na2SO3固体与18.4molL-1硫酸
(5)预测SOCl2遇水反应的化学方程式为___。
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在Cl-的试剂有____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计实验,对下列物质所含官能团进行检验。
(1)为了证明溴乙烷中存在溴原子,某同学设计如下实验:
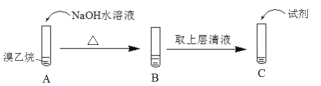
① 将试管C中加入的试剂及相应的实验现象补充完整:_______。
② 溴乙烷在NaOH水溶液中反应的化学方程式是______。
(2)用化学方法检验![]() 含有的官能团。
含有的官能团。
① 完成下表:
官能团 | 检验试剂 | 实验现象 | 化学方程式 |
—OH | FeCl3溶液 | 溶液呈紫色 |
|
—COOH | _______ | 有无色气泡产生 | _______ |
② 不能用溴水检验是否含有碳碳双键,简述理由:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示氢气燃烧热的是( )
A. H2(g)+![]() O2(g)=H2O(g)△H=﹣241.8 kJ/mol
O2(g)=H2O(g)△H=﹣241.8 kJ/mol
B. 2H2(g)+O2(g)=2H2O(g)△H=﹣483.6 kJ/mol
C. H2(g)+![]() O2(g)=H2O(l)△H=﹣285.8 kJ/mol
O2(g)=H2O(l)△H=﹣285.8 kJ/mol
D. 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( )
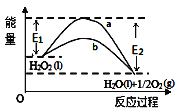
A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l)═H2O(l)+ ![]() O2(g)△H=﹣(E1﹣E2)kJ/mol
O2(g)△H=﹣(E1﹣E2)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠是家用消毒剂的有效成分。实验室制备次氯酸钠的装置如下图甲所示。
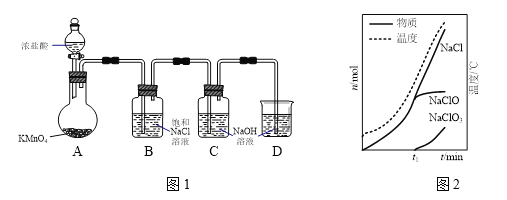
(1)装置C中生成各物质的物质的量和溶液的温度随时间的变化如图乙所示。t1分钟后所发生主要反应的化学方程式为________________________。
(2)如果要减少NaClO3的生成,可以采取的方法是_________、___________(填两种)。
(3)由装置C中的溶液得到次氯酸钠样品。假设该次氯酸钠样品中混有的杂质为NaClO3或NaCl中的一种。称取2.0225 g样品于锥形瓶中,加水使其完全溶解,向溶液中加入200 mL 0.60 mol·L-1的FeSO4溶液(过量),充分反应。再向溶液中滴加0.50 mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液20.00 mL。请计算样品中NaClO的质量分数____________(写出计算过程)。
已知:H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com