
【题目】下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- =BaSO4↓+H2O
【答案】D
【解析】
A.电镀时,镀层金属作阳极,镀件作阴极, 在阴极上,镀层金属阳离子获得电子,向铁制器具上电镀铜,阴极上Cu2+得电子变为单质Cu,反应原理符合事实,A正确;
B.电解饱和食盐水,溶液中的阴离子Cl-在阳极上失去电子变为Cl2,水电离产生的H+在阴极上获得电子变为H2,总反应方程式为:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,B正确;
H2↑+Cl2↑+2OH-,B正确;
C.CaSO4在溶液中存在沉淀溶解平衡,当向溶液中加入饱和Na2CO3溶液时,由于c(Ca2+)·c(CO32-)>Ksp(CaCO3),会形成CaCO3沉淀,使CaSO4不断溶解,最终实现了沉淀的转化,C正确;
D.向氢氧化钡溶液中加入稀硫酸,二者反应产生BaSO4沉淀和H2O,产生的二者的物质的量的比是1:2,离子方程式为:Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O,D错误;
故答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业上有重要用途。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) ![]() 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化![]() 与
与![]() 生成
生成![]() 。将一定比例的
。将一定比例的![]() 、
、![]() 和
和![]() 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

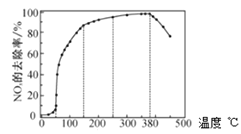
反应相同时间![]() 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在![]() 范围内随着温度的升高,
范围内随着温度的升高,![]() 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使![]() 去除反应速率迅速增大,上升阶段缓慢主要是____________;当反应温度高于
去除反应速率迅速增大,上升阶段缓慢主要是____________;当反应温度高于![]() 时,
时,![]() 的去除率迅速下降的原因可能是_________。
的去除率迅速下降的原因可能是_________。
(4)如图为利用肼![]() —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。

左图负极反应式为:___________。当上图阴极上放出2.24L气体![]() 标准状况
标准状况![]() 时,图中硫酸铜溶液的pH=______(溶液体积变化忽略不计)。
时,图中硫酸铜溶液的pH=______(溶液体积变化忽略不计)。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料,在有机合成中有着广泛的应用。
I.已知:烯烃复分解反应是指在催化剂作用下,实现![]() 两边基团换位的反应:2CH2=CHCH3
两边基团换位的反应:2CH2=CHCH3![]() CH3CH=CHCH3+CH2=CH2。经测定
CH3CH=CHCH3+CH2=CH2。经测定![]() 的一种同分异构体M的核磁共振氢谱有三个峰,峰面积之比为1:3:
的一种同分异构体M的核磁共振氢谱有三个峰,峰面积之比为1:3:![]() 下图为M合成Q的流程图。
下图为M合成Q的流程图。

![]() 的名称为 ______ ;
的名称为 ______ ;
![]() 的化学反应类型为 ______ ;
的化学反应类型为 ______ ;
![]() 写出
写出![]() 的化学方程式 ______ 。
的化学方程式 ______ 。
![]() 有机物
有机物![]() 广泛用作香精的调香剂。实验室的科技人员利用M的一种同分异构体,通过下列流程合成有机物E。
广泛用作香精的调香剂。实验室的科技人员利用M的一种同分异构体,通过下列流程合成有机物E。

![]() 的化学方程式为 ______ ;
的化学方程式为 ______ ;
![]() 已知X的环上只有一个取代基,且取代基无支链,则E的结构简式为 ______ ;
已知X的环上只有一个取代基,且取代基无支链,则E的结构简式为 ______ ;
![]() 写出满足以下条件的X的同分异构体的结构简式: ______
写出满足以下条件的X的同分异构体的结构简式: ______
![]() 遇
遇![]() 溶液显紫色
溶液显紫色![]() 苯环上的一氯取代物只有两种。
苯环上的一氯取代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(Fe3+)=0.1mol/L 的溶液:![]() 、Na+、Cl、
、Na+、Cl、![]()
B.碱性溶液中:Al3+、Fe3+、![]() 、
、![]()
C.水电离出的c(H+)=1×1012mol/L的溶液:![]() 、
、![]() 、
、![]() 、Cl
、Cl
D.pH =12的溶液中:Na+、![]() Cl、
Cl、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
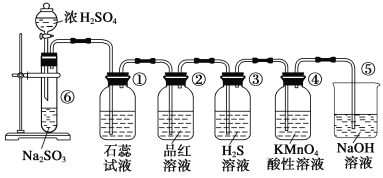
(1)在⑥中发生反应的化学方程式为___________。
(2)②中的品红溶液__________,证明SO2有________性。
(3)④中的实验现象是______,证明SO2有______性。
(4)⑤的作用是________,反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)基态o原子的外围电子排布图________________________;基态p3+的最外层电子排布式___________________;n的原子结构示意图____________________。在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上________________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_________________________________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序________________________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备乙炔和研究乙炔性质的实验装置图,下列有关说法错误的是( )
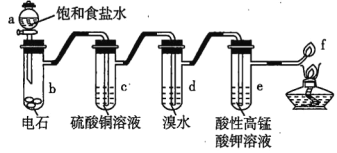
A.a中用饱和食盐水代替蒸馏水可使产生乙炔的速率更易控制
B.c中CuSO4 溶液的作用是除去影响后续实验的杂质
C.d、e中溶液褪色的原理不同,前者是氧化反应,后者是加成反应
D.f 处产生明亮、伴有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
(1)常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-)
(2)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
(4)常温下,已知酯酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh:水的离子积为Kw:则有:Ka·Kh=Kw
(5)电解精炼铜时,电解质溶液中铜离子浓度不变
(6)如图装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③

A.(1)(4)(6)
B.(1)(2)(4)(6)
C.(2)(4)(5)
D.(2)(3)(4)(6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com