
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是______填分子式;
(2)分别写出⑦、⑧中所含官能团的名称____________、____________二者发生酯化反应的化学方程式为_________________________________________________,如果用4.6g乙醇和9.0g乙酸充分反应制得乙酸乙酯5.28g,则本实验的产率是:__________产率指的是目标生成物的实际产量与理论产量的比值。
(3)上述物质中,能发生加成反应的烃类物质有:__________________________填序号。
(4)下列物质中,不能通过乙烯加成反应得到的是______填序号。
a.CH3CH3b.CH3CHCl2c.CH3CH2Br
(5)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是____________________________。
【答案】CH4 羟基 羧基 CH3CH3OH+CH3COOH![]() CH3COOCH2CH3 +H2O 60% ③④⑤⑥ b 3
CH3COOCH2CH3 +H2O 60% ③④⑤⑥ b 3 ![]()
【解析】
(1)最简式中H、C原子个数比越大,H原子的质量分数越大;
(2)乙醇含—OH,乙酸中含—COOH,二者发生酯化反应生成乙酸乙酯和水;用4.6g乙醇和9.0g乙酸充分反应,乙酸的物质的量(0.15mol)大于乙醇的物质的量(0.1mol),乙醇完全反应,理论上生成0.1mol×88g/mol=8.8g;
(3)含双键、三键及苯环的烃可发生加成反应;
(4)乙烯可与氢气、HBr、氯气发生加成反应;
(5) 二甲苯分子中两个甲基在苯环上的位置有邻、间、对三种,要从苯环和侧链分析其一氯代物,据此分析解答。
(1)最简式中H、C原子个数比越大,H原子的质量分数越大,则上述物质中甲烷(CH4)中H的质量分数最大,其化学式是CH4;
(2)⑦、⑧中所含官能团的名称分别为羟基、羧基,二者发生酯化反应生成乙酸乙酯和水,反应时酸脱羟基醇脱氢,反应方程式为为CH3COOH+ CH3CH2OH ![]() CH3COOCH2CH3+H2O;用4.6g乙醇和9.0g乙酸充分反应,乙酸的物质的量(0.15mol)大于乙醇的物质的量(0.1mol),所以乙醇完全反应,理论上生成0.1mol×88g/mol=8.8g,充分反应制得乙酸乙酯5.28g,但本实验的产率是(5.28g÷8.8g) ×100%=60%;
CH3COOCH2CH3+H2O;用4.6g乙醇和9.0g乙酸充分反应,乙酸的物质的量(0.15mol)大于乙醇的物质的量(0.1mol),所以乙醇完全反应,理论上生成0.1mol×88g/mol=8.8g,充分反应制得乙酸乙酯5.28g,但本实验的产率是(5.28g÷8.8g) ×100%=60%;
(3)含双键、三键及苯环的烃可发生加成反应,在上述物质中,能发生加成反应的烃类物质有③④⑤⑥;
(4)乙烯可与氢气、HBr、氯气发生加成反应分别生成CH3CH3、CH3CH2Br、ClCH2CH2Cl,只有b物质( CH3CHCl2)不可能反应产生;
(5) 二甲苯的结构有邻二甲苯、间二甲苯、对二甲苯三种不同结构;其中一种被称为“PX”,它的一氯代物只有两种,说明在其苯环上只有一种位置的H原子,测链上有一种H原子,该物质为对二甲苯,其结构简式是![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与对应的结论或解释正确的是
选项 | 操作 | 现象 | 结论或解释 |
A | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰吴黄色 | 原溶液中有 |
B | 将 | 溶液紫色褪去 |
|
C | 向 | 得到澄清溶液 |
|
D | 向盛有少量溴水的分液漏斗中加入裂化汽油,充分振荡,静置 | 上、下层液体均近无色 | 裂化汽油不可用作溴的萃取溶剂 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
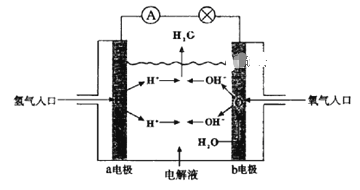
A. a电极是负极
B. 氢氧燃料电池是一种具有应用前景的绿色电源
C. b电极的电极反应为:4OH--4e-=2H2O+O2↑
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是:
A.  和
和 互为同分异构体
互为同分异构体
B. 15g甲基(﹣CH3)含有的电子数是9NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 用0.2000 molL-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 molL-1),当pH=7时,溶液中的酸恰好完全中和
D. 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 molL-1盐酸、③0.1 molL-1氯化镁溶液、④0.1 molL-1硝酸银溶液中,Ag+浓度:④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是
A. 反应中被氧化和被还原的元素分别为Cu和N
B. 反应中氧化剂和还原剂的物质的量之比为3∶2
C. 反应中产生0.2 mol气体时,转移0.6 mol电子
D. 该反应中被还原的CuO占参与反应CuO的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Cu组成的2.64 g混合物投入到100 mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中逐滴加入2 mol·L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图。以下说法不正确的是( )

A. 稀硝酸的浓度为1.9 mol/L
B. 生成的NO在标况下的体积为0.896 L
C. a的值为15
D. Cu的物质的量为0.02 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com