
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下的22.4L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.8 g Na2O2含有的阴离子数目为0.1 NA
D.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA
科目:高中化学 来源: 题型:
【题目】如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
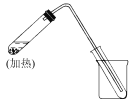
(1)左边大试管中要加入几片碎瓷片,其作用是_________________;
(2)该装置中使用的玻璃导管较长,其作用是__________________;
(3)烧杯中还要盛有的物质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
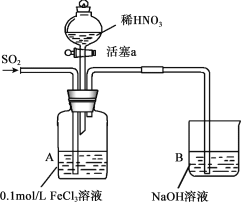
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述): 。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
(3)实验II中发生反应的离子方程式是 。
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示) 。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是 。
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
①该原子的摩尔质量是aNA
② Wg该原子的物质的量一定是 ![]()
③Wg该原子中含有![]() 个该原子
个该原子
④由已知信息可得:![]()
A.①② B.③④ C.②③ D.① ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是

A. 反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1
C. 反应进行到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)≒Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 常温下,l L 0.l mol·L-1NH4NO3溶液中含有的NH4+ 数是0.l NA
C. 常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA
D. 铁铝混合物与一定量盐酸反应生成1 mol H2时,转移电子数是2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
H2(g)+Br2(g)=2HBr(g) ΔH=-akJ/mol则a是
A.404 B.72 C.230 D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol,自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com