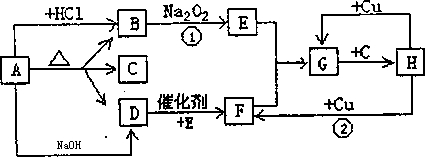
解:Zn+2H2SO4 (浓)═ZnSO4+SO2↑+2H2O,
(1)通常状况下,1体积水中可溶解40体积的二氧化硫气体,装置乙可防止二氧化硫与品红作用时被吸入锌与硫酸反应的容器中,二氧化硫与品红作用,需长管进,
故答案为:3(或4),4(或3)接b,c接2,1;
(2)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,然后再与澄清的石灰水反应,起缓冲作用,可防止倒吸,
故答案为:防倒吸;
(3)二氧化硫可使品红溶液褪色,可检验二氧化硫的存在,
故答案为:C中品红溶液褪色;
(4)二氧化硫和澄清的石灰水反应生成亚硫酸钙和水,亚硫酸钙为难溶于水的沉淀,
故答案为:Ca2++2OH-+SO2═CaSO3↓+H2O;
(5)锌为较活泼的金属,在金属活动顺序表中排在氢的前面,所以锌和稀硫酸反应生成硫酸锌和氢气,
故答案为:Zn+H2SO4(稀)═ZnSO4+H2↑;
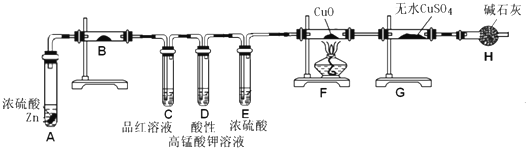
(6)二班小组设计的装置,先用白色的无水硫酸铜检验水的存在,后用品红检验二氧化硫的存在,用高锰酸钾氧化二氧化硫除去二氧化硫,浓硫酸具有吸水性,除去水,锌和稀硫酸反应生成氢气和硫酸锌,氢气通过氧化铜生成铜和水,水蒸气遇无水硫酸铜变蓝色,可检验氢气的存在,
故答案为:验证产物中先产生水、SO2,后产生H2;
(7)水蒸气遇无水硫酸铜变蓝色,检验水的存在,
故答案为:无水CuSO4(或无水硫酸铜);
(8)二氧化硫可使品红溶液褪色,C中品红褪色,可检验二氧化硫的存在,高锰酸钾氧化二氧化硫可除去二氧化硫,D中酸性高锰酸钾不再褪色后,说明二氧化硫已经除尽,锌和稀硫酸反应生成氢气和硫酸锌,氢气通过氧化铜生成铜和水,F中有红色物质生成,说明有铜生成,G中无水硫酸铜变蓝,说明有水生成,说明有氢气产生,
故答案为:C中品红褪色,D中酸性高锰酸钾不再褪色后,F中有红色物质生成,G中无水硫酸铜变蓝;
分析:Zn+2H2SO4 (浓)═ZnSO4+SO2↑+2H2O
(1)选择装置防止倒吸;
(2)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,可防止倒吸;
(3)浓硫酸中硫为+6价,具有强氧化性,被锌还原为+4价的硫;
(4)二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀;
(5)锌与稀硫酸反应生成硫酸锌和氢气;
(6)锌和浓硫酸反应生成硫酸锌和二氧化硫和水,当硫酸浓度变稀时,锌与稀硫酸反应生成硫酸锌和氢气,用无水硫酸铜检验水的存在,品红检验二氧化硫的存在,氧化铜检验氢气的存在;
(7)白色的无水硫酸铜遇水变蓝色;
(8)用品红检验二氧化硫的存在,高锰酸钾具有强氧化性,能氧化二氧化硫,用无水硫酸铜检验水的存在;
点评:本题主要考查了锌和硫酸的反应,注意浓硫酸和二氧化硫的性质是解答本题的关键,题目较为基础.



 Fe2O3
Fe2O3  Fe2(SO4)3
Fe2(SO4)3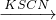 Fe(SCN)3
Fe(SCN)3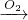 Na2O
Na2O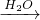 NaOH
NaOH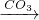 NaHCO3
NaHCO3 SiO2
SiO2 NaSiO3
NaSiO3 H2SiO3
H2SiO3 Al
Al NaAlO2
NaAlO2 Al(OH)3
Al(OH)3