
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
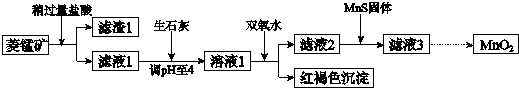
分析 菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,系列转化得到MnO2.
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成;
(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,结合电荷守恒、原子守恒配平;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成;
②生成氯气发生氧化反应,在阳极产生,用润湿的淀粉碘化钾试纸检验;
③其它条件不变下,增大Mn2+浓度,有利于Mn2+放电.
解答 解:菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,系列转化得到MnO2.
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O,
故答案为:增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+,
故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,反应离子方程式为:MnS+Cu2+=Mn2++CuS,
故答案为:MnS+Cu2+=Mn2++CuS;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+,
故答案为:4H2O;Cl2↑;5MnO2;8H+;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
故答案为:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;
③Mn2+、Cl-都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电),
故答案为:其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
点评 本题物质制备实验,明确原理是解题关键,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
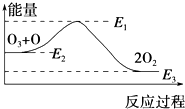 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z的原子半径r(T)>r(W)>r(Z) | |
| B. | 由X、Y、Z氢化物的热稳定性X>Y>Z | |
| C. | X最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | W元素的单质具有半导体的特性,可以用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全反应后不可能有O2剩余 | |
| B. | 原混合气体中C2H4与C2H2的体积共为1.9L | |
| C. | 完全反应后生成水的质量为9 g | |
| D. | 原混合气体中CO与CH4的体积之比一定为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2H+=2H2O+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com