
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
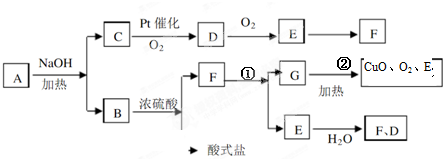
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
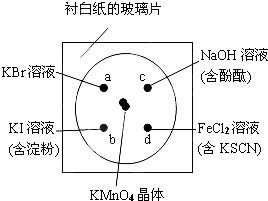 所谓微型化学实验就是以尽可能少的化学试剂获取所需化学信息的实验方法与技术.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度均为0.1mol/L的KBr溶液、KI溶液(含淀粉)、NaOH溶液(含酚酞)、FeCl2溶液(含KSCN)各一滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向晶体上滴加一滴浓盐酸,再立即将表面皿盖好.
所谓微型化学实验就是以尽可能少的化学试剂获取所需化学信息的实验方法与技术.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度均为0.1mol/L的KBr溶液、KI溶液(含淀粉)、NaOH溶液(含酚酞)、FeCl2溶液(含KSCN)各一滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向晶体上滴加一滴浓盐酸,再立即将表面皿盖好.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com