


| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
| VL |
| 22.4L/mol |
| (a-b)g | ||
|
| 22.4(a-b) |
| V |
| 22.4(a-b) |
| V |
| 22.4(a-b) |
| V |


科目:高中化学 来源: 题型:

| A、能将电能转换成化学能 |
| B、碳棒发生氧化反应 |
| C、该装置中发生的反应为:Cu+2Fe3+═2Fe2++Cu2+ |
| D、电子从碳棒经外电路流向铜棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、成键过程中吸收能量 |
| B、断键过程中吸收能量,成键过程中释放能量 |
| C、断键过程中释放能量 |
| D、断键过程中释放能量,成键过程中吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)
Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)查看答案和解析>>
科目:高中化学 来源: 题型:
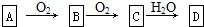
查看答案和解析>>
科目:高中化学 来源: 题型:
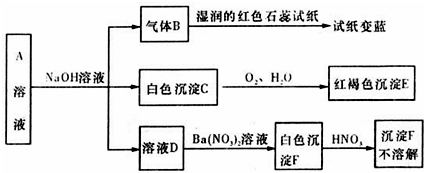
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com