
| A.X与Y两气体的相对分子质量之比为m:n |
| B.同温同压下X与Y两气体的密度之比为n:m |
| C.等质量气体X与Y所含分子数之比为n:m |
| D.同温同压下,等体积的X与Y质量比为m:n |
科目:高中化学 来源: 题型:
| m |
| 100 |
| m |
| 12 |
| m |
| 100 |
| m |
| 12 |
| n(CaCO3) |
| n(C) |
| n(CaCO3) |
| n(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3000m |
| 112V |
| 3000m |
| 112V |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As元素 |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
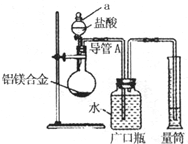 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.| 过量盐酸 |
| 过量NaOH溶液 |
| 过量盐酸 |
| 过量NaOH溶液 |
| 3W2 |
| 5m |
| 3W2 |
| 5m |
| () |
查看答案和解析>>
科目:高中化学 来源: 题型:
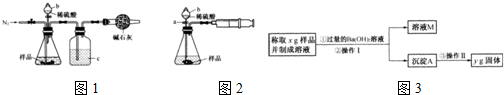
| 106y |
| 197x |
| 106y |
| 197x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com