
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M 四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W 和Z 形成的常见化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X 元素形成的单质晶体不一定是原子晶体 |
分析 由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
W在短周期主族元素中原子半径最大,所以W为Na元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
W在短周期主族元素中原子半径最大,所以W为Na元素,
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>N>H,即W>Y>M,故A正确;
B.由X、Y、Z、M四种元素形成的化合物可为氨基酸或碳酸铵、醋酸铵等物质,氨基酸中只有共价键,故B错误;
C.W 和Z 形成的常见化合物为氧化钠和过氧化钠,两种物质中阴、阳离子物质的量之比均为1:2,故C正确;
D.X为C,形成的单质有金刚石、石墨、C60等,只有金刚石为原子晶体,所以单质晶体不一定是原子晶体,故D正确.
故选B.
点评 本题考查元素推断、元素周期律、分子结构及C、N、Na元素化合物性质等,侧重于学生的分析能力的考查,难度中等,根据密度判断Y与M形成的气态化合物是氨气为推断的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
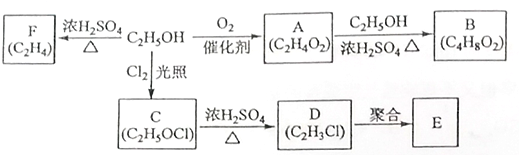
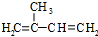 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$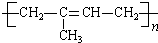 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
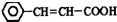 ,可由化合物甲生成.其转化关系及相应反应如下:
,可由化合物甲生成.其转化关系及相应反应如下: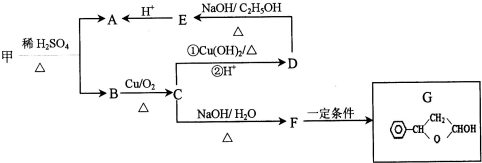

 .
. (写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为
(写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为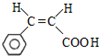 .
.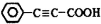 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的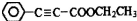 路线(其他试剂任选)
路线(其他试剂任选)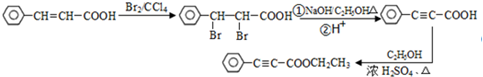 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
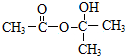 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3体积/mL | 26.90 | 26.55 | 27.00 | 26.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

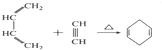
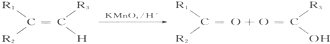
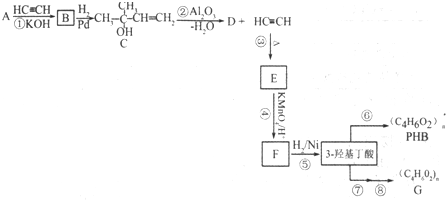
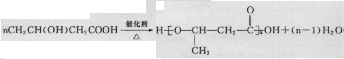
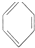 B.
B.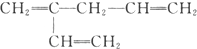 C.
C.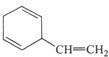 D.
D.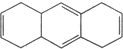
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com