
【题目】(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键 | C—H | C—F | H—F | F—F |
键能 | 414 | 489 | 565 | 158 |
根据键能数据计算以下反应的反应热△H: CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=____。
(2)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则反应HI(g)
2HI(g)的平衡常数K1为49,则反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)==的平衡常数K3为__________。
I2(g)==的平衡常数K3为__________。
(4)在一定条件下将CO2与H2混合转化为甲醇CH3OH是一种新型脱碳技术,这一反应同时生成H2O,实现了绿色环保、节能减排、废物利用等目的。在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。

①该反应方程式为______________
②0~10 min内,氢气的平均反应速率为________;
③该温度下,反应的平衡常数为________(保留三位有效数字);
④10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
【答案】1928kl/mol 1/7 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 0.225mol/(L·min) 5.33 增大
CH3OH(g)+H2O(g) 0.225mol/(L·min) 5.33 增大
【解析】
(1)化学反应的焓变=反应物总键能-生成物总键能。CH4(g)+4F2(g)=CF4(g)+4HF(g),△H=(414KJ/mol×4+158KJ/mol×4)-(489KJ/mol×4+565KJ/mol×4)=-1928KJ/mol,故答案为:-1928KJ/mol;
(2)反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1=c2(HI)/[c(H2)c(I2)]= 49
2HI(g)的平衡常数K1=c2(HI)/[c(H2)c(I2)]= 49
HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)==的平衡常数K3=
I2(g)==的平衡常数K3=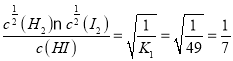 ,所以本题答案:
,所以本题答案:![]() ;
;
(3)①由图可知,CO2为反应物,CH3OH为生成物,由已知在一定条件下将CO2与H2混合转化为甲醇CH3OH同时生成H2O,10min时反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,△c(CH3OH)= 0.75mol/L,所以该反应的化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+ +H2O(g);答案:CO2(g)+3H2(g)
CH3OH(g)+ +H2O(g);答案:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
②10min内,v(CO2)= 0.75mol/L /10min =0.075mol/(L·min),反应速率之比等于计量数之比,v(H2)=3v(CO2)=3×0.075mol/(Lmin)=0.225mol/(Lmin);所以0~10 min内,氢气的平均反应速率为0.225mol/(Lmin);答案:0.225mol/(Lmin);
③开始CO2的浓度为1mol/L,故容器的体积为1mol/1molL=1L,H2的起始浓度为3mol/L=3mol/L,则
: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
开始(mol/L) 1 3 0 0
变化(mol/L) 0.75 2.25 0.75 0.75
平衡(mol/L) 0.25 0.75 0.75 0.75
故该温度下平衡常数k= 0.75×0.75/[ 0.25×0.753]=5.33;
④第10min后,向该容器中再充入1molCO2和3molH2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大;答案:增大。


科目:高中化学 来源: 题型:
【题目】在化学反应 3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O 中,硝酸中被还原和未被还原的氮元素的质量比是
A. 3:1 B. 1:1 C. 1:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mA(s)+nB(g)qC(g) △H<0的可逆反应,在一定温度下达平衡时,B的体积分数ф(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )

A. m+n<qB. n>q
C. x点的混合物中v (正)<v (逆)D. x点比y点的混合物的正反应速率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为__________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_________________________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_______________________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_________;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,请回答下列问题:

(1)图中甲池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)A(石墨)电极的名称是_________ (填“正极” “负极” “阴极”或“阳极”)
(3)写出通入CH3OH的电极的电极反应式________________
(4)乙池中反应的化学方程式为__________________。当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲苯的实验事实中,能说明苯环对侧链性质产生影响的是
A.甲苯燃烧产生带浓烟的火焰B.甲苯能使酸性KMnO4溶液褪色
C.甲苯的硝化反应生成三硝基甲苯D.甲苯能与H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com