
【题目】下表是元素周期表的一部分,回答下列有关问题:
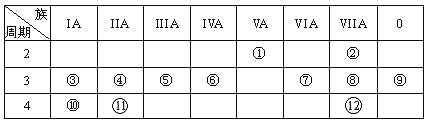
(1)画出原子的结构示意图:④______________
(2)在①~12元素中,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)元素⑤的最高价氧化物的水化物分别与元素③⑧的最高价氧化物的水化物反应的离子方程式_________,
(5)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程:_____。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:______
【答案】![]() F Ar Cl b Al(OH)3 + OH- =AlO2- + 2H2O ;Al(OH)3 +3H+ =Al3+ + 3H2O
F Ar Cl b Al(OH)3 + OH- =AlO2- + 2H2O ;Al(OH)3 +3H+ =Al3+ + 3H2O ![]()
![]() +
+![]() →
→
【解析】
根据表中位置可知①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是S,⑧是Cl,⑨是Ar,⑩是K,是Ca,是Br。
(1)④是Mg,为12号元素,位于第三周期,其电子结构示意图为![]() ;
;
(2)同周期时,自左往右非金属性越来越强,同主族时,自上而下非金属性越来越弱,在①~12元素中,非金属性最强的元素是②即F,稀有气体化学性质很稳定,最不活泼的元素是⑨,即Ar;
(3)元素⑦与元素⑧位于同周期,同周期时,自左往右非金属性越来越强,因而非金属性较强的是⑧,即Cl,下列表述中能证明这一事实的是:a.常温下⑦的单质和⑧的单质分别是S和Cl2,S是固体,Cl2是气体,状态不同,但不能判断非金属性强弱,错误;
b.元素的气态氢化物越稳定,元素的非金属性越强,⑧的氢化物比⑦的氢化物稳定,可判断S的非金属性弱于Cl,正确;
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应,但不可以判断非金属性强弱,c错误。
故选b。
(4)元素⑤的最高价氧化物的水化物是Al(OH)3,元素③⑧的最高价氧化物的水化物分别是NaOH、HClO4,Al(OH)3具有两性,可与强碱反应得到偏铝酸盐,与酸反应生成铝盐,离子方程式分别是Al(OH)3 + OH- =AlO2- + 2H2O ;Al(OH)3 +3H+ =Al3+ + 3H2O;
(5)同周期时,自左往右原子半径越来越小,除稀有气体原子,故第三周期中原子半径最大的元素是Na,原子半径最小的元素是Cl,它们可以形成化合物为NaCl,氯化钠的电子式为![]() ,Na和Cl的电子式分别是
,Na和Cl的电子式分别是![]() 、
、![]() ,用电子式表示其形成过程:
,用电子式表示其形成过程:![]() ;
;
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,假设电子层数为两层,则次外层一定为2个,则最外层为4个,核外电子总数为6,该元素为C元素,与⑧形成一种AB4型的化合物为CCl4,CCl4电子式为 ,C和Cl的电子式分别是
,C和Cl的电子式分别是![]() 、
、![]() ,用电子式表示其形成过程:
,用电子式表示其形成过程:![]() +
+![]() →
→ 。
。


科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3S +6KOH=K2SO3 +2K2S +3H2O 中,作还原剂和作氧化剂的硫原子个数比为
A.1:2 B.2:1 C.1:1 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内有a mol A生成的同时生成3a mol B;③A、B、C的浓度不再变化;④容积不变的密闭容器中混合气体的总压强不再变化;⑤混合气体的物质的量不再变化;⑥单位时间消耗a mol A,同时生成3a mol B;⑦A、B、C的分子数目之比为1∶3∶2。
2C(g)达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内有a mol A生成的同时生成3a mol B;③A、B、C的浓度不再变化;④容积不变的密闭容器中混合气体的总压强不再变化;⑤混合气体的物质的量不再变化;⑥单位时间消耗a mol A,同时生成3a mol B;⑦A、B、C的分子数目之比为1∶3∶2。
A. ②⑤ B. ①③ C. ②⑦ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) (单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) (单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
A. 4v(NH3)=5 v(O2)B. 5 v(O2)=6 v(H2O)
C. 2v(NH3)=3 v(H2O)D. 4v(O2)=5 v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号,每空只填一个):
富含维生素C的是___;可直接进入血液,补充能量的是___;应用最广泛的抗生素之一的是___;食用过多会引起血压升高、肾脏受损的___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
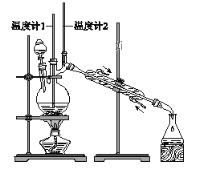
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模型示意图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | 熔点1873 K |
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com