
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
① H2O2的分解反应氧化还原反应(填“是”或“不是”).
②该分解反应0─20min的平均反应速率v(H2O2)为molL﹣1 min﹣1 .
③如果反应所用的H2O2溶液为100mL,则共产生O2g.
A.0.08 B.0.16 C.1.28 D.2.4.
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。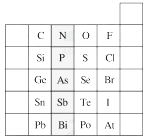
(1)阴影部分元素在元素周期表中的位置为族。
(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?。
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是。试写出Si的氢化物完全燃烧的化学方程式:。
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:。
(5)试比较S、O、F三种元素的原子半径大小:(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2 , 而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。 
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)装置①中发生反应的离子方程式是;
(2)装置②的目的是 , 发生反应的化学方程式是;
(3)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是 ;
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后(此操作的目的是),最后滴加浓硝酸;
(5)该小组得出的结论所依据的实验现象是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
A.N一定是HCl(aq)
B.X可能为Al或Cl2
C.Y一定为NaOH(aq)
D.Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1mol FeI2与足量氯气反应时转移的电子数为2NA
B.常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C.1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过滤操作正确的是( )。
A. 过滤操作中,漏斗下端与烧杯内壁不相互接触
B. 若发现滤纸漏液,可继续过滤
C. 为加快过滤速度,可用玻璃棒搅拌漏斗中的液体
D. 玻璃棒下端应紧靠三层滤纸处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种原子晶体
B. B4C是一种离子晶体
C. B4C是一种分子晶体
D. B4C分子是由4个硼原子和1个碳原子构成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图Ⅱ所示.则下列结论正确的是( )

A.该反应的热化学方程式为:A(g )+3B(g) 2C(g);△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com