
莽草酸结构简式如图。下列说法错误的是
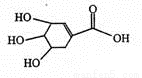
A. 该物质分子式为C7H10O5
B.该物质与乙酸互为同系物
C.该物质能与乙醇发生酯化反应
D.1 mol该物质与Na反应时,最多消耗Na 4 mol
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷(解析版) 题型:选择题
下列各组物质按酸、碱、盐分类顺序排列正确的是
A.硫酸、纯碱、碳酸钙 B.硝酸、烧碱、食盐
C.冰醋酸、烧碱、生石灰 D.盐酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:选择题
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是

A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
C.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷(解析版) 题型:填空题
(1)写出下列物质的化学式:硫铁矿 石膏
(2)SiO2是硅最重要的化合物,其用途是 (举一例)
(3)已知1g乙醇完全燃烧生成液态水放出29.7kJ的热量,写出乙醇燃烧热的热化学方程式 。
(4)配平化学方程式:___K2Cr2O7+___HCl——___KCl+___CrCl3+___Cl2↑+___H2O
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。SnSO4的实验室制备设计路线如下:

下列有关说法正确的是
A.SnCl2酸化是为了防止溶解时发生水解
B.反应I中发生的离子反应为:CO32-+2H+=CO2↑+ H2O
C.漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次
D.操作1为过滤,操作2为盐析
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
七铝十二钙(12CaO•7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含MgO和 ;用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上学期期中考试化学试卷(解析版) 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O),已知氯化铜易溶于水,难溶于乙醇。

(1)溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验出溶液1中Fe2+的试剂是 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
(2)试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的(填序号) 。
A.NaOH
B.NH3·H2O
C.CuO
D.Cu2(OH) 2CO3
E.CuSO4
调节pH至4~5的原因是 。
(3)配制实验所需480mL10mol/L浓HCl时用到的玻璃仪器有:量筒、玻璃棒、烧杯、 。
(4)得到CuCl2·xH2O晶体最好采用的干燥方式是 。
A.空气中加热蒸干
B.空气中低温蒸干
C.HCl气流中加热烘干
D.HCl气流中低温烘干
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。根据实验数据测得x= (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________。
A.缩小容器容积
B.及时分离出Y、Z
C.使用合理的催化剂
D.升高体系温度
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:______________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com