
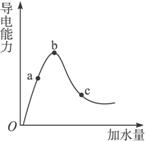
图3-2
(1)“O”点导电能力为零的理由是__________。
(2)a、b、c三点处,溶液的c(H+)由大到小的顺序为___________________。
(3)a、b、c三点处,电离程度最大的是_____________________。
(4)若使c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施为:
①________。②________。
③________。④_________。
科目:高中化学 来源: 题型:
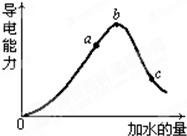 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下冰醋酸加水稀释的过程中,溶液的导电能力如图3-2所示,请完成下列问题:
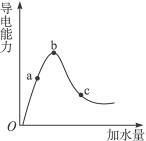
图3-2
(1)“O”点导电能力为零的理由是__________。
(2)a、b、c三点处,溶液的c(H+)由大到小的顺序为___________________。
(3)a、b、c三点处,电离程度最大的是_____________________。
(4)若使c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施为:
①________。②________。
③________。④_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com